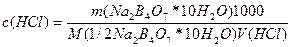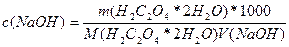|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Приготовление и стандартизация 0,1М раствора щелочи
Лабораторная работа. Кислотно-основное титрование Приготовление и стандартизация 0,1М раствора хлороводородной кислоты Краткое теоретическое вступление. Стандартизация раствора хлороводородной кислоты методом отдельных навесок основана на титровании точной навески буры раствором кислоты в присутствии метилового оранжевого: Na2B4O7 + 2HC1 + 5Н2О = 4Н3ВО3 + 2NaCl. Стандартный раствор хлороводородной кислоты готовят разбавлением концентрированного раствора НС1. Цель. Определить точную концентрацию приготовленной соляной кислоты. Ход выполнения. Рассчитывают объем концентрированной хлороводородной кислоты, необходимый для приготовления 250 мл 0,1М раствора. Рассчитанный объем кислоты переносят в мерную колбу вместимостью 250 мл, ополаскивают мерный цилиндр 2-3 раза дистиллированной водой, сливая промывную жидкость в ту же колбу. Разбавляют раствор водой до метки и тщательно перемешивают. Для определения точной концентрации кислоты используют тетраборат натрия Na2B4O7 * 10Н2О (буру). Расчет навески буры на одно титрование (расход кислоты ≈10 мл):
Методом отсыпания взвешивают несколько точных навесок буры (0,19+0,04 г) в конические колбы для титрования. В каждую колбу приливают приблизительно по 20 мл дистиллированной воды, перемешивают до растворения всех кристаллов буры и вводят 1-2 капли индикатора метилового оранжевого. Бюретку ополаскивают 2-3 раза несколькими миллилитрами (2-3 мл) приготовленного раствора кислоты, заполняют и, установив уровень кислоты в бюретке на нуле, приступают к титрованию. Кислоту приливают сначала быстро (до -15 мл), все время перемешивая круговыми движениями содержимое колбы, а затем по каплям до перехода окраски от желтой к оранжевой. Делают отсчет объема кислоты, затраченного на титрование (с точностью до сотых долей миллилитра), и записывают в журнал. Для титрования второй навески буры снова доливают кислоту в бюретку, устанавливают уровень раствора на нулевом делении и титруют вторую навеску, а затем третью. Обработка результатов: Рассчитывают молярную концентрацию раствора хлороводородной кислоты для каждой навески по формуле
Если расхождение между отдельными определениями не превышает 0,2-0,3%, берут среднее значение молярной концентрации НС1 из трех результатов. Приготовление и стандартизация 0,1М раствора щелочи Краткое теоретическое вступление. Стандартизация раствора гидроксида натрия основана на титровании точной навески щавеливой кислоты или аликвоты стандартного раствора щавелевой кислоты раствором гидроксида натрия в присутствии фенолфталеина. Точная концентрация раствора гидроксида натрия может быть установлена также по титрованному раствору хлороводородной кислоты. Стандартный раствор гидроксида натрия готовят разбавлением концентрированного бескарбонатного ратсвора щелочи. Цель: Определить точную концентрацию приготовленного гидроксида натрия. Ход выполнения. Рассчитать навеску гидроксида натрия необходимую для приготовления 250 мл 0,1н раствора. Взвешивание производят на технохимических весах.
m(NaOH) = c(NaOH)*V(NaOH)*M(NaOH) = 0,1*0,25*40 = 1 г
Стандартизация раствора щелочи по титрованному раствору хлороводородной кислоты.Предварительно вымытую бюретку ополаскивают 2-3 раза малыми порциями (3-5 мл) приготовленного раствора NaOH. Заполняют бюретку раствором щелочи. Отбирают аликвоту (10 мл) стандартного раствора хлороводородной кислоты в коническую колбу для титрования и приливают 1-2 капли метилового оранжевого. Титруют раствором щелочи сначала быстро, а под конец по каплям до перехода розовой окраски в желтую. При титровании с метиловым оранжевым удобно пользоваться свидетелем. Для его приготовления в коническую колбу для титрования вносят с помощью мерного цилиндра 40 мл дистиллированной воды, 1 каплю метилового оранжевого и 1-2 капли 0,1М раствора хлороводородной кислоты. Молярную концентрацию раствора щелочи рассчитывают по формуле c(NaOH) = c(HCl)V(HCl)/V(NaOH), где V(НС1) - объем пипетки, которой дозировалась хлороводородная кислота; - объем щелочи, израсходованной на титрование кислоты. Если значения молярной концентрации NaOH по результатам трех титрований различаются не больше чем на 0,2-0,3%, берут в качестве наиболее вероятного значения среднее арифметическое. При больших расхождениях проводят повторное титрование. Стандартизация раствора щелочи по щавелевой кислоте (Н2С2О4*2Н2О). Метод отдельных навесок. Рассчитывают навеску щавелевой кислоты, чтобы на ее титрование расходовалось ≈10 мл 0,1М раствора щелочи. На аналитических весах методом отсыпания взвешивают три навески. Растворяют навеску щавелевой кислоты примерно в 20 мл дистиллированной воды, свободной от СО2. Прибавляют в каждую из колб по 3-4 капли фенолфталеина и титруют раствор щавелевой кислоты раствором щелочи. Титрование заканчивают, когда окраска раствора становится малиновой и сохраняется в течение примерно 30 с. Обработка результатов: Рассчитывают молярную концентрацию раствора щелочи для каждой из взятых навесок по формуле
Если расхождение значений c(NaOH) для трех титрований не превышает 0,2%, берут среднее значение из всех результатов. Выводы:
Поиск по сайту: |