|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Производство Азотной кислоты
Получение. В лаборатории азотную кислоту получают действием концентрированной серной кислоты на кристаллический нитрат натрия или калия при небольшом нагревании: NaNO3 + H2SO4 t® NaHSO4 +HNO3 При более сильном нагревании образуется сульфат натрия, но в этих условиях азотная кислота разлагается. В промышленности, азотную кислоту получают окислением аммиака кислородом воздуха в присутствии катализатора. Для ознакомления с этим методом можно воспользоваться прибором (рис. 3).
Рисунок 3 – Получение азотной кислоты окислением аммиака кислородом воздуха.
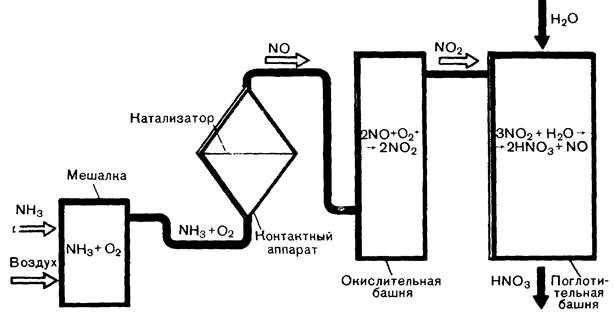
При пропускании струи воздуха, к которому добавлен кислород, через 10 – 12 %-ный аммиачный раствор образуется смесь аммиака с воздухом. В трубке под действием катализатора (смесь порошкообразного оксида хрома (III) или оксида марганца (IV) с асбестом) происходит окисление аммиака, и образовавшийся оксид азота (IV) поглощается в колбе водой, в которую добавлен индикатор. Процесс получения азотной кислоты в промышленности протекает в несколько стадий (рис. 4): 1) подготовка аммиачно-воздушной смеси; 2) окисление аммиака до оксида азота (II), 3) окисление оксида азота (II) до оксида азота (IV); 4) поглощение оксида азота (IV) водой и получение азотной кислоты.
Рисунок 4 – Схема получения азотной кислоты в промышленности.
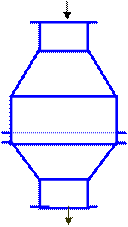
Аммиачно-воздушную смесь получают непосредственным перемешиванием аммиака с воздухом, предварительно очищенного от примесей. Эта смесь поступает в контактный аппарат (рис. 5), где под влиянием катализатора (платинородиевые сетки) происходит окисление аммиака: 4NH3 + 5O2 = 4NO + 6H2O + Q Так как эта реакция экзотермическая, то необходимая температура поддерживается за счет выделяемой теплоты. Подогревание требуется только перед пуском аппарата.
Аммиачно-воздушная смесь
Нитрозные газы
Рисунок 5 – Контактный аппарат. Окисление оксида азота (II) до оксида азота (IV) происходит при обычной температуре: 2NO + O2 ® 2NO2 Поэтому выходящую из контактного аппарата газовую смесь, содержащую оксид азота (IV), охлаждают, пропуская ее в паровой котел-утилизатор, где получают водяной пар. Газовую смесь, содержащую оксид азота (IV), направляют в поглотительную башню, которая для увеличения поверхности соприкосновения газа с водой заполнена фарфоровыми кольцами. Вода в башню поступает сверху, а газовая смесь, содержащая оксид азота (IV) – снизу (принцип противотока). Реакция протекает так: 3NO2 + H2O ® 2HNO3 + NO При избытке кислорода реакция протекает без выделения оксида азота (II): 4NO2 +2H2O Û 4HNO3 + Q Реакция оксида азота (IV) с водой экзотермическая и обратимая. Это объясняется тем, что азотная кислота при нагревании разлагается. Поэтому на обычных установках удается получить раствор невысокой концентрации, содержащий только 0,50 – 0,60 массовых долей, или 50 – 60 %, азотной кислоты. Чтобы сместить равновесие вправо, увеличивают давление. На некоторых заводах при давлении около 5 МПа получают концентрированный раствор, содержащий 0,98 массовых долей, или 98 %, азотной кислоты.
Поиск по сайту: |