 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ДИКАРБОНОВИМІ КИСЛОТАМИ називають похідні вуглеводнів, які містять в своєму складі дві карбоксильні групи
Лекція № 12 Карбонові кислоти
Загальна формула карбонових кислот: Класифікація карбонових кислот Залежно від природи радикала, пов'язаного з карбоксильною групою, кислоти ділять на:
Число карбоксильних груп визначає основність кислот:
Загальна формула насичених одноосновних кислот: СnH2n+1COOH (або СnH2nO2). Номенклатура Поширені тривіальні назви. За правилами IUPAC до назви вуглеводня додають "-ова кислота".
Ізомерія карбонових кислот 1. Для аліфатичних кислот – ізомерія вуглеводневого радикалу. 2. Для ароматичних - ізомерія положення замісника при бензольному кільці. 3. Міжкласова ізомерія з естерами (наприклад, CH3COOH і HCOOCH3).
Одержання 1) окиснення первинних спиртів і альдегідів киснем в присутності каталізаторів KMnO4; K2Cr2O7:
2) промисловий синтез мурашиної кислоти: a) каталітичне окиснення Метану 2CH4 + 3O2 ––t°® 2H–COOH + 2H2O б) нагріванням оксиду вуглецю (II) з гідроксидом натрію CO + NaOH ––p;200°C® H–COONa ––H2SO4® H–COOH
3) промисловий синтез оцтової кислоти: a) каталітичне окиснення Бутану 2CH3–CH2–CH2–CH3 + 5O2 ––t°® 4CH3COOH + 2H2O б) нагріванням суміші оксиду вуглецю (II) і метанолу на каталізаторі під тиском CH3OH + CO ® CH3COOH 4) окисненням гомологів бензолусинтезують ароматичні кислоти: 5 толуол бензойна кислота 5) гідроліз функціональних похідних (складних ефірів, ангідридів, галогенангідридів, амідів). СH3COOС2Н5 ––t°, Н2О® СH3COOН + С2Н5ОН етилацетат етанова кислота етанол
Хімічні властивості 1. Через зсув електронної густини від гідроксильної групи O–H до сильно поляризованої карбонільної групи C=O молекули карбонових кислот здатні до електролітичної дисоціації: R–COOH « R–COO- + H+ Сила карбонових кислот у водному розчині невелика.
2. Карбонові кислоти володіють властивостями, характерними для мінеральних кислот. Вони реагують з активними металами, основними оксидами, основами, солями слабких кислот: 2СH3COOH + Mg ® (CH3COO)2Mg + H2 2СH3COOH + СaO ® (CH3COO)2Ca + H2O H–COOH + NaOH ® H–COONa + H2O 2СH3CH2COOH + Na2CO3 ® 2CH3CH2COONa + H2O + CO2 СH3CH2COOH + NaHCO3 ® CH3CH2COONa + H2O + CO2 Карбонові кислоти слабшіі за багато сильних мінеральних кислот (HCl, H2SO4 і т.д.) і тому витісняються ними з солей: СH3COONa + H2SO4(конц.) ––t°® CH3COOH + NaHSO4
3. Утворення функціональних похідних: a) при взаємодії із спиртами (у присутності концентрованої H2SO4) утворюються складні ефіри. Утворення складних ефірів при взаємодії кислоти і спирту у присутності мінеральних кислот називається реакцією ЕСТЕРИФІКАЦІЇ (ester з латинського "ефір"). Дану реакцію розглянемо на прикладі утворення метилового ефіру оцтової кислоти з оцтової кислоти і метилового спирту:
CH3– ® CH3–
Загальна формула складних ефірів (естерів) R– Зворотною реакцією є гідроліз складного ефіру (ОМИЛЕННЯ):
CH3– метилацетат етанова кислота метанол
Як видно, процес етерифікації оборотний:
CH3– При настанні хімічної рівноваги в реакційній суміші знаходитимуться як початкові, так і кінцеві речовини. Каталізатор (іони водню) – однаково прискорюють пряму і зворотну реакції, тобто досягнення рівноваги. Щоб зсунути рівновагу у бік утворення естеру, слід брати в надлишку початкові кислоту або спирт, або видаляти один з продуктів реакції зі сфери взаємодії – наприклад, відганяючи естер або зв'язуючи воду водовіднімаючими засобами.
б) при дії водовіднімаючих реагентів в результаті міжмолекулярної дегідратації утворюються ангідриди: CH3– оцтовий ангідрид
c) при обробці карбонових кислот п'ятихлористим фосфором одержують хлорангідриди CH3– хлорангідрид оцтової кислоти
Гідроліз всіх функціональних похідних карбонових кислот (ангидридів, хлорангидридів, складних ефірів і ін.) приводить в кислому середовищі до початкових карбонових кислот, а в лужному середовищі – до їх солей.
4. Галогенування. При дії галогенів (у присутності червоного фосфору) утворюються
a- Галогензаміщені кислоти – більш сильні кислоти, ніж карбонові, за рахунок електроноакцепторних властивостей атома галогену.
До ненасичених карбонових кислот відносяться карбонові кислоти, які містять у вуглеводному радикалі кратний зв'язок. В номенклатурі ненасичених кислот широко використовують тривіальні назви. За ІЮПАК назви ненасичених кислот утворюють аналогічно насиченим, використовуючи суфікс –ен для позначення подвійного зв'язку і суфікси –ин для позначення потрійного. Реакційна здатність ненасичених монокарбонових кислот зумовлена наявністю в їх структурі карбоксильної групи, зокрема, вони утворюють солі, галогенангідриди, ангідриди, естери, аміди. По кратному зв'язку у вуглеводневому радикалі ненасичені кислоти мають властивості алкенів (алкінів). ВИЩІ КАРБОНОВІ КИСЛОТИ були виділені з жирів, тому одержали назву жирних. Ці з'єднання (ВЖК) входять до складу багатьох ліпідів – групи речовин, що містяться в тваринних і рослинних тканинах, що виконують ряд важливих функцій не розчинних у воді, але розчинних в малополярних розчинниках. ВЖК, в більшості, монокарбонові кислоти з нерозгалуженим вуглецевим ланцюгом і парним числом атомів Карбону (частіше всього 16 і 18 атомів). ВЖК проявляють хімічні властивості, характерні для карбонових кислот взагалі. У ліпідах організму людини ВЖК можуть бути представлені насиченими (стеаринова, пальмітинова) і ненасиченими (олеїнова, лінолева, линоленова, арахідонова) кислотами, рідше – циклічними і гідроксикислотами. Особливо важлива роль поліненасичених лінолевої і ліноленової кислот як сполук, незамінних для людини. Вони сприяють зниженню в крові холестеролу – одного з чинників розвитку атеросклерозу. Застосування Мурашина кислота– в медицині, в бджільництві, в органічному синтезі, при отриманні розчинників і консервантів; як сильний відновник. Оцтова кислота– в харчовій і хімічній промисловості (виробництво ацетилцелюлози, з якої одержують ацетатне волокно, органічне скло, кіноплівку; для синтезу фарбників, медикаментів і складних ефірів). Масляна кислота– для отримання ароматизуючих добавок, пластификаторів і флотореагентів. Щавлева кислота– в металургійній промисловості (видалення окалини). СтеариноваC17H35COOH і пальмітинова кислоти C15H31COOH – як поверхнево-активні речовини, змащувальні матеріали в металообробці. Олеїнова кислотаC17H33COOH – флотореагент і збирач при збагаченні руд кольорових металів.
ДИКАРБОНОВИМІ КИСЛОТАМИ називають похідні вуглеводнів, які містять в своєму складі дві карбоксильні групи. НО– У номенклатурі дикарбонових кислот застосовують тривіальні назви. За номенклатурою ІЮПАК назви дикарбонових кислот утворюють з назв відповідних вуглеводнів з додаванням префікса – ди-, суфікса – ова і слова кислота.
COOH ½ COOH етандіова кислота (щавлева кислота)
Ізомерія дикарбонових кислот обумовлена різною структурою вуглецевого скелету. Одержують дикарбонові кислоти тими ж методами, що і монокарбонові, використовуючи як початкові речовини біфункціональні сполуки. За хімічними властивостями дикарбонові кислоти схожі до монокарбонових, але утворюють два ряди похідних (дисоціюють ступінчасто – утворюють солі кислі і середні, естери повні і неповні, галогенангідриди та аміди). Крім того, дикарбоновв кислоти проявляють ряд специфічних властивостей: а) при нагріванні декарбоксилюються по одній карбоксильній групі і перетворюються на монокарбонові; б) починаючи з янтарної кислоти при нагріванні утворюють циклічні ангідриди (янтарний та глутаровий, у випадку нагрівання гександіової кислоти - циклопентанон).
Ненасичені дикарбонові кислотимістять в своєму складі дві карбоксильні групи і кратний вуглець-вуглецевий зв'язок. Представниками даних кислот є малеїнова і фумарова кислоти, які є геометричними цис- і транс- ізомерами. Так, малеїнова і фумарова кислоти відрізняються розташуванням карбоксильних груп відносно площини, яка проходить через середину π-звязку (рис.6)
Рис.6. Геометричні ізомери: а) малеїнові кислота (цис-ізомер), б) фумарола кислота (транс-ізомер) За хімічними властивостями ці кислоти схожі до насичених мононокарбонових кислот і ненасичених вуглеводнів. Ароматичні дикарбонові кислоти містять дві карбоксильні групи безпосередньо сполучені з ароматичним ядром. Найважливішими представниками є фталева кислота і її ізомери.
Поиск по сайту: |




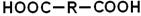
 + 6KMnO4 + 9H2SO4 ––t°® 5
+ 6KMnO4 + 9H2SO4 ––t°® 5  + K2SO4 + 6MnSO4 + 14H2O
+ K2SO4 + 6MnSO4 + 14H2O –OH оцтова кислота + HO–CH3 метиловый спирт ®
–OH оцтова кислота + HO–CH3 метиловый спирт ®