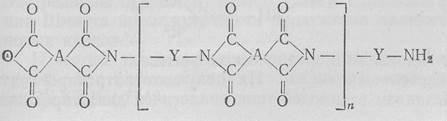|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ
АМИДЫ И ИМИДЫ КАРБОНОВЫХ КИСЛОТ, ЛАКТАМЫ
МЕТОДЫ ПОЛУЧЕНИЯ Амиды и имиды карбоновых кислот получают взаимодействием карбоновых кислот или их функциональных производных с аммиаком или аминами. Наиболее трудно реагируют сами карбоновые кислоты. Вначале образуются аммониевые соли, которые при нагревании выше 200 °С превращаются в амиды или имиды:
g - и d-Аминокарбоновые кислоты легко циклизуются в лактамы:
Легко реагируют с аммиаком и аминами ацилгалогениды, ангидриды, сложные эфиры:
ФИЗИЧЕСКИЕ СВОЙСТВА И СТРОЕНИЕ Амиды и имиды представляют собой бесцветные кристаллические вещества или жидкости, растворяющиеся в воде и органических растворителях. Амиды, в молекулах которых имеются связи N—Н, ассоциированы вследствие образования межмолекулярных водородных связей и имеют более высокие температуры кипения. В молекулах амидов осуществляется значительное взаимодействие между неподеленной электронной парой атома азота и п-электронной системой двойной связи С=O. Образуется сопряженная система связей, изменяются природа связей С—N и С=O и распределение электронной плотности. В результате связь С—N становится короче, а связь С=O несколько длиннее по сравнению с несопряженными соединениями:
Атомы амидной группировки С(CO)N находятся в одной плоскости, вращение по амидной связи С—N в значительной степени заторможено, связь имеет некоторый характер двойной связи. Это можно изобразить резонансными формулами:
ХИМИЧЕСКИЕ СВОЙСТВА АМИДЫ Амиды отличаются по своим свойствам от сложных эфиров. У них более выражено взаимодействие с электрофильными реагентами, но уменьшена реакционная способность с нуклеофилами. Это объясняется уменьшением — I-эффекта групп в ряду CI, OOCR, OR1, NH2 (d>dI>dII>dIII) и увеличением электронодонорного +М-эффекта (dIV<dV<dVI<dVII):
Кроме того, для амидов характерен ряд реакций с участием связей N—Н:
(здесь Х=Сl, Вr).
1. Основность. По сравнению с аминами амиды карбоновых кислот являются слабыми основаниями ввиду сильного взаимодействия неподеленной электронной пары атома азота с карбонильной группой. Присоединение протона обычно происходит по атому кислорода:
Протонированная форма амидов имеет структуру имидовых кислот и является сильной ОН-кислотой. Например, рKвн+ ацетамида равен 0,1, бензамида —2, капролактама 0,4. Имиды являются очень слабыми основаниями, в этом они сравнимы со спиртами и эфирами. В протонированной форме амидов положительный заряд на углеродном атоме значительно больше, чем в амидной форме. Это способствует реакциям со слабыми нуклеофильными реагентами. 2. NH-Кислотность. Если в молекуле амида имеется связь N—Н, возможна ионизация. Амиды являются слабыми NH-кислотами. Повышенная кислотность амидов по сравнению с аминами объясняется сильным влиянием карбонильной группы (эффект сопряжения, делокализация отрицательного заряда в анионе):
Кислотность ацетамида (рKа=15) сравнима с кислотностью метанола, кислотность бензамида рKа= 13,5. Имиды являются более сильными NH-кислотами, так как атом азота находится под влиянием двух карбонильных групп:
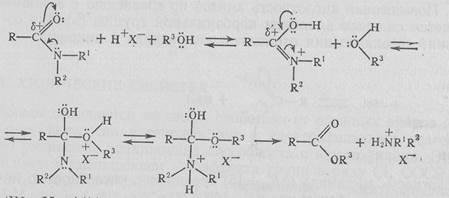
3. Реакции нуклеофильного замещения. В реакциях с нуклеофильными реагентами может произойти замещение группы NH2 (NR2):
Реакционная способность амидов меньше, чем сложных эфиров. Наиболее известны реакции с водой (гидролиз) и спиртами (алкоголиз). Гидролиз амидов легко происходит в присутствии щелочи или кислоты и очень медленно — в нейтральной среде. В присутствии щелочи амиды превращаются в соль карбоновой кислоты и аммиак (амины):
Если R1 или R2 являются водородными атомами, промежуточно образуется также анион амида. Присутствие кислоты активирует молекулу амида (протонирование), поэтому происходит реакция со слабыми О-нуклеофилами — водой и спиртами:
(R3=H, Alk).
Имиды в реакциях с нуклеофилами более активны, так как влияние атома азота на одну карбонильную группу меньше. 4. Образование и превращения N-галогенамидов. N-Незамещенные или N-монозамещенные амиды легко галогенируются у атома азота. Обычно действуют галогенами в присутствии оснований:
N-Галогенамиды являются весьма нестабильными соединениями и обладают свойствами окислителя. Их применяют в качестве галогенирующих реагентов. Разрыв связи N—галоген может осуществиться гомолитически:
Особой реакционной способностью обладают N-галогенамиды связью N—Н, которые в щелочной среде образуют соли:
Соли N-галогенамидов при нагревании превращаются в первичные амины:
Впервые эту реакцию наблюдал А. Гофман в 1881 г. (расщепление амидов по Гофману). Промежуточными продуктами в реакции Гофмана являются изоцианаты, которые образуются в результате перегруппировки своеобразных частиц — ацилнитренов. Ацилнитрены — аналоги кето-карбенов — образуются из N-галогенамидов:
Изоцианаты очень легко реагируют с водой и образуют карбами новые кислоты, которые декарбоксилируются:
5. Взаимодействие с электрофильными реагентами, дегидратация. Электрофильные реагенты атакуют кислородный атом. Сильные алкилирующие реагенты дают производные имидоэфиров (гл. XXXIII. Ж.1). Сильные кислоты Льюиса вызывают дальнейшие превращения. N-Незамещенные амиды превращаются в нитрилы (гл. XXXIII. К.1):
N,N-Дизамещенные амиды с РОС13 дают производные хлорангидрида имидокислот — активные ацилирующие реагенты. Например, N,N-диметилформамид с РОС13 дает соль N.N-диметил-хлорформимидиния — активный формилирующий реагент:
ИМИДЫ
Присутствие двух карбонильных групп в молекуле имидов увеличивает кислотность атома водорода аминогруппы, снижает нуклеофильность как атома кислорода, так и азота, а также увеличивает дефицит электронов на карбонильном атоме углерода. Если принять во внимание указанные различия, то реакции имидов можно рассматривать как достаточно близкие к реакциям амидов. Так, например, с большим трудом, чем в случае имидов протекают хорошо известные реакции нуклеофильного присоединения к карбонильному атому углерода (гидролиз или реакция с реактивами Гриньяра), а также реакции с электрофильными реагентами (алкилгалогенидами, ацилирующими и галогенирующи-ми агентами и карбонильными соединениями). Вместе с тем имеется несколько примеров реакций с нитрозирующими и нитрующими агентами, а также с галогенангидридами неограниче-с.ких кислот. Имиды достаточно устойчивы к окислению, но легко восстанавливаются и подвергаются фотолизу. Гидролиз имидов легко проходит как в кислой, так и в основной среде, при этом основной катализ имеет место при низких рН (=3), некатализируемый процесс реализуется при рН 2— 3, а кислотный катализ протекает при рН менее 1,5. В результате гидролиза происходит разрыв N-ацильной связи и имид деацилируется до амида. В случае циклических имидов продуктами являются амидовые кислоты, которые в зависимости от условий могут подвергаться дальнейшему гидролизу до дикарбоновых кислот и амина или аммиака.
Механизм катализируемого основаниями гидролиза сукцинимидов относительно прост и включает первоначальную атаку _ОН на карбонильный углерод и последующее образование тетраэдрического интермедиата, который затем распадается с разрывом связи С (О)—N. Наблюдаемое влияние размера цикла (в случае циклических имидов) и природы заместителей у атома N' можно было ожидать, например происходит возрастание скорости реакции при переходе от пятичленных (планарных) к шестичленным циклам вследствие меньшей стерической затрудненности карбонильного атома углерода, а также при замене N-алкильных групп на N-фенильные. Фталимид проявляет необычные свойства, вероятно, из-за сильной ионизации очень кислой группы N—Н. Скорость реакций зависит от рН, но наличие электронооттягивающего заместителя в положении 4 облегчает гидролиз при рН 7—10; при более высоких рН скорость реакции не зависит от рН и не зависит от природы заместителя. Напротив, скорость гидролиза N-арилфталимидов зависит от рН даже при высоких значения рН. Катализируемый кислотой гидролиз имидов затруднен и обычно требует продолжительного нагревания при 80—100°С. Поэтому промежуточно образующийся амид не выделяют, но гидролизуют дальше до карбоновой кислоты и аммиака или амина. Поскольку скорость реакции растет с увеличением кислотности, ее механизм включает, вероятно, атаку воды на протонированный субстрат. Образуются ли в данном случае О- или N-сопряженные кислоты, точно не установлено. Наблюдалось возрастание скорости гидролиза фталимидов за счет влияния соседних карбоксильных групп, а также за счет нуклеофильного катализа соседних имидазольных и аминогрупп. Как и в случае амидов, хорошо известна атака на карбонильный атом углерода имидов таких нуклеофильных реагентов как спирты (сольволиз), амины, гидроксиламин и гидразин, которая приводит в первых двух случаях к раскрытию цикла с образованием амидовых эфиров и диамидов соответственно. В случае гидразина и гидроксиламина происходит последующее замыкание цикла, которое сопровождается включением в имидный цикл более нуклеофильного NH2- и НО-замещенного атома азота с образованием 1,1-диацилгидразинов и N-ацилгидроксамовых кислот соответственнно. Имиды, как и амиды, взаимодействуют с карбанионами (полученными из реактивов Гриньяра) по карбонильному атому углерода. Первой стадией реакции является образование замещенного a-гидроксилактама, затем в зависимости от природы реактива Гриньяра может протекать дегидратация или раскрытие цикла:
Конкретные примеры таких реакций рассмотрены в упомянутых выше обзорах. В связи с повышенным по сравнению с амидами дефицитом электронов на карбонильном углероде имиды могут присоединять некоторые менее активные карбанионы, такие как анионы из цинка и a-галогенэфиров или фосфоранов (реакции Реформатского и Виттига, давая алкилиденовые производные; а также взаимодействовать с ацетиленидом натрия, давая гидроксилактамы. Алкилирование имидов алкилгалогенидами обычно протекает в основных условиях (т. е. с калиевой или серебряной солью имида) при 150—180 °С и приводит к N-алкилпроизводным.
Эта реакция составляет основу синтеза аминов по Габриэлю, в котором получение амина состоит в мягком гидролизе имида после алкилирования алкилгалогенидом. Алкилирование в нейтральных условиях более активными солями оксо-ния или алкилсульфатами изучено недостаточно. Однако имеются данные о внутримолекулярном О-алкилировании имида соседней галогеналкильной группой, что приводит к возникновению N-ацилгетероциклической соли в качестве интермедиата с последующим раскрытием цикла и образованием амидового эфира.
Эта реакция аналогична получению лактамов из ω-галогеналкиламидов. Как и в случае амидов, при взаимодействии 2 моль амида натрия с соответствующим имидом (например, глутаримидом), происходит образование карбаниона (в a-положенни по отношению к карбонилу) и аниона азота, однако обычно преимущественно алкилируется карбанион, а не азот. Реакции имидов с альдегидами и кетонами очень близки аналогичным реакциям вторичных амидов. Так, формальдегид, ацетон и изобутиральдегид реагируют в нейтральных или основных условиях, давая соответствующие N-a-гидроксиалкильные производные, которые в случае высших гомологов могут далее дегидратироваться. Ацилирование незамещенных имидов хлорангидридами или ангидридами кислот приводит к триациламинам (RCO)3N. Имеются косвенные доказательства того, что в слабоосновных условиях (например, в пиридине) реакция протекает через промежуточное образование О-ацильных производных. При взаимодействии с более активными ацилирующими агентами, например с кетенами и с изопренильными эфирами, образуются N-замещенные продукты, аналогичные получаемым из амидов. В случае N-алкилдиацетамидов дальнейшее замещение по азоту невозможно, однако с помощью 14С-меченого уксусного ангидрида в пиридине продемонстрирован факт транс-ацилирования. N-Галогенимиды, получаемые из соответствующего имида действием молекулярного галогена или гипогалогенит-иона, являются хорошо известными источниками атомарного или положительно заряженного галогена. Широкое применение в синтезе нашел главным образом N-бромсукцинимид. Гетеролитиче-ское бромирование под действием N-бромсукцинимида (т. е. через НОВr или Вr_) может происходить: в водной среде, когда присоединение к олефинам идет согласно правилу Марковникова; в концентрированной H2SO4 где замещение в ароматическом кольце протекает согласно орто/пара-ориентации, а также в смеси пиридина и трет-бутанола, где вторичные спирты подвергаются a-замещению. Гомолитическое галогенирование под действием N-бромсукцинимида (т. е. через Hal-) протекает либо при облучении УФ-светом, либо в присутствии инициаторов радикальных реакций, например пероксидов. Типичными реакциями такого типа являются замещение аллильного или бензильного атома водорода (реакция Воля — Циглера), замещение в ароматическом ядре или даже замещение водорода у насыщенного атома углерода. Эти реакции являются цепными радикальными процессами; их детали зависят от природы N-галогенимида. Другими интересными, но менее важными реакциями N-гало-генимидов являются введение СНг-группы между азотом и галогеном по связи Н—Hal, а также катализируемая основаниями перегруппировка N-галогенфталимида, приводящая к изоцианатам (аналогичная реакция Гофмана для амидов).
Данные по нитрованию и нитрозированию имидов отсутствуют, а количество примеров реакций с галоганангидридами неорганических кислот незначительно. Взаимодействие РС15 с глутаримидом приводит к ди-, три- и тетрахлорированным пиридинам, образование которых объясняется процессом, уже рассмотренным в случае амидов. РОС13 реагирует аналогичным образом. Имиды очень устойчивы к окислению, и на них не действуют такие реагенты, как оксид азота, оксид хрома и перманганат калия. Это свойство имидов дало возможность применить удобный метод защиты амидных групп (путем превращения в имид) в процессе окисления других фрагментов молекулы. Имиды гладко восстанавливаются с помощью таких стандартных методов, как взаимодействие с комплексными гидридами металлов, каталитическое гидрирование и электрохимическое восстановление. Из циклических имидов обычно образуются a-гидроксилактамы, лактамы и амины.
Электрохимическое восстановление на свинцовом или на амальгамированном цинковом катоде, а также восстановление LiAlH4 обычно приводит к получению лактамов. При действии LiAlHi наличие заместителей в кольце может способствовать образованию a-гидроксилактамов. Каталитическое гидрирование обычно приводит к амидам. Хотя как имиды, так и амиды, поглощают в УФ-области приблизительно при той же длине волны, фотохимия имидов до последнего времени не вызывала интереса. Известные сейчас фотоперегруппировка Фриса ароматических имидов и перенос атома хлора в N-хлоримидах в g-положение ацильной боковой цепи напоминают процессы, описанные в случае амидов.
Другими интересными перегруппировками под действием УФ-света являются расширение
цикла N-алкиламидов и раскрытие имидного кольца с образованием ацилизоцианата.
Последняя реакция может конкурировать с реакциями фотоиндуцированного бромирования.
ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ Формамид HCONH2 — бесцветная гигроскопическая жидкость; кипит при 210,5 °С, смешивается с водой и спиртами. ' Получают его из метилформиата и аммиака. Применяют в качестве растворителя и исходного в органическом синтезе. N ,N-Диметилформамид (ДМФА) — бесцветная жидкость со слабым запахом; кипит при 153°С, смешивается с водой и органическими растворителями. В промышленности его получают в больших количествах из ди-метиламина и оксида углерода под давлением. ДМФА применяют в качестве растворителя для растворения ацетилена, полимеров, для проведения синтезов. ДМФА хорошо сольватирует катионы за счет взаимодействия е кислородным атомом, но не сольватирует анионы, нет подвижного водородного атома. Такие растворители называются биполярными апротонными. ДМФА применяется также для реакций формилирования ния Сукцинимид (имид янтарной кислоты) — бесцветное кристаллическое вещество с т. пл. 126 °С, растворимое в воде. Получают его нагреванием аммониевой соли янтарной кислоты. Сукцинимид используют в органическом синтезе. Важным его производным является N-бромсукцинимид, который применяют для бромирования и окисления органических соединений. Фталимид — бесцветное кристаллическое вещество; т. пл. 238 °С, легко возгоняется. Получают его из фталевого ангидрида и аммиака при 170—240 °С. Фталимид является слабой NH-кислотой (рКа=8,3). Он растворяется в водных щелочах, но постепенно происходит гидролиз с раскрытием цикла и образованием соли фталаминовой кислоты. Соли фталимида получают в безводных средах. Их используют в органическом синтезе, например для получения первичных аминов алкилированием и расщеплением полученного N-алкилфталимида.
Для гидролиза N-замещенных фталимидов используют щелочь, кислоту. Лучше всего использовать реакцию с гидразином, в результате чего образуется гидразид фталевой кислоты и первичный амин. Фталимид используется для получения антраниловой кислоты и других аминокислот.
a-Пирролидон используют в качестве растворителя и для получения N-винилпирролидона, который является важным мономером для получения различных полимеров. Большое значение имеет чистый поливинилпирролидон с молекулярной массой около 20 000, который растворяется в воде. Его водный раствор используют в медицине как заменитель кровяной плазмы и для дезинтоксикации организма. Производное пирролидона—N-метилпирролидон является хорошим биполярным апротонным растворителем. Он отлично растворяет также различные полимеры. ε-Капролактам—бесцветное кристаллическое вещество с т. пл. 68°С, растворяется в воде. Производится в значительных количествах. Одним из основных методов является перегруппировка Бекмана оксима циклогексанона в присутствии 20—25%-ного олеума:
При 250—260 °С капролактам в присутствии слабокислых или основных катализаторов полимеризуется с образованием полиамида — поли-ε-капроамид. Полиамиды являются высокомолекулярными соединениями (М=10 000...30 000), макромолекулы которых содержат амидные группировки CONH. Полиамиды получают двумя способами: из диаминов и дикарбоновых кислот или их производных и из ω-аминокарбоновых кислот или их лактамов. В табл. 46 перечислены важнейшие полиамиды, которые используются в промышленности синтетических волокон и других изделий. Таблица 46. Важнейшие полиамиды
Структурой полиамидов формально обладают также полипептиды и белки. Полиимиды являются высокомолекулярными соединениями, макромолекулы которых содержат имидные группировки. Получают их из диангидридов тетракарбоновых кислот и диаминов. Полиимидные пленки нерастворимы и имеют большую термическую стабильность (300—350°С):
Обычно для получения полиимидных пленок применяют пиромеллитовый диангидрид
и 4,4'-диаминодифениловый эфир
Используют полиимиды главным образом в качестве электроизоляционных материалов.
Поиск по сайту: |














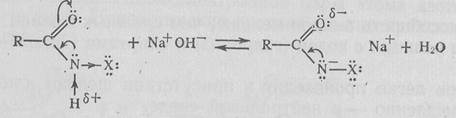














 a-Пирролидон (g-бутиролактам) представляет собой бесцветное низкоплавкое (т. пл. 25,6°С) вещество ст. кип. 245°С, растворяется в воде. Получают его из бутиролактона и аммиака.
a-Пирролидон (g-бутиролактам) представляет собой бесцветное низкоплавкое (т. пл. 25,6°С) вещество ст. кип. 245°С, растворяется в воде. Получают его из бутиролактона и аммиака.