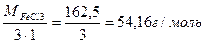|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Атомно-молекулярного вчення
Мета: сформувати професійні навички розв’язування завдань різних типів на визначення молярної маси еквівалентів, маси, об’єму, кількості речовини, відносної густини газів. Провести розрахунки за хімічними формулами і рівняннями реакцій на підставі основних законів хімії.
Задачі на використання: 1. Закону збереження маси речовин. 2. Закону сталості складу речовини. Масова частка елементів. 3. Закону еквівалентів. 4. Закону Авогадро. Прилади та матеріали: періодична система хімічних елементів Д.І Менделєєва, калькулятор. & Теоретичне обґрунтування теми
Склад хімічних сполук і зміни їхнього складу, що відбуваються в результаті хімічних реакцій, підпорядковуються кількісним законам хімії: закону збереження маси речовин, закону сталості складу, закону кратних (об’ємних) відношень, закону Авогадро та закону еквівалентів. Знання закону збереження маси речовин дає змогу складати рівняння хімічних реакцій. Добираючи коефіцієнти до формул речовин, зрівнюють число атомів усіх видів у лівій і правій частинах і дістають хімічне рівняння, що відповідає закону збереження маси. За ним можна обчислювати масу речовин, кількості речовини та об’єми газів, що вступають у реакцію, або утворюються внаслідок реакції. Наприклад: Задача.Обчислити масу гідроксиду калію, потрібного для добування 26 г гідроксиду міді (ІІ). Розв’язання
m(Cu(OH)2=26 г CuCl2 + 2KOH = Cu(OH)2 + 2KCl
М(КОН)=39+16+1=56 г/моль М(Сu(ОН)2 = 64+16×2+ 1×2=98 г/моль m(КОН)=M×n=56г/моль×2моль=112г m (Сu(ОН)2 = M×n = 98г/моль×1моль=98 г 112 : 98 = х : 26; х = Відповідь: маса гідроксиду калію становить 29,71 г. На основі закону сталості складу можна проводити різні розрахунки за хімічними формулами: · обчислювати відносну молекулярну та молярну масу речовини. Наприклад: Мr(СuFeS2) = 64 + 56 + 32×2 = 184; М(СuFeS2) = 184 г/моль; · визначати відношення мас елементів у сполуці, наприклад, для сполуки СuFeS2: m(Cu): m(Fe): m(S) = 64 : 56 : 64 = 8 : 7 : 8 · встановлювати масову частку (w) будь-якого елементу в хімічній сполуці. Наприклад, для сполуки СuFeS2: w(Cu) = w (Fe)= · визначати масу речовини за відомою масою елементу, що входить до складу речовини. Наприклад: 9,2 г х г х г 6,4 г СuFeS2 → Fe СuFeS2 → Сu 184 г 56 г 184 г 64 г х = · визначати кількість речовини елементу за відомою кількістю речовини вихідної сполуки. Наприклад: 3 моль х г 2 моль х моль СuFeS2 → Сu СuFeS2 → 2S 1 моль 64 г 1 моль 2 моль х = На основі закону Авогадро можна розраховуватиоб’єми, кількість речовини, молекулярні маси та відносну густину газу, для чого потрібно усвідомити зв’язок між наступними фізичними величинами: - молярна маса (М) М = - маса речовини (m) m = Vp; m = Mn кг, г; - кількість речовини (n) n = - молярний об’єм ( Vm) Vm = - відносна густина (D) D = На основі закону еквівалентів можна визначати молярні маси еквівалентів (Мекв.) складних речовин:
Мекв.(кислоти)= Мекв.(солі)= Хід роботи.
І. Закон збереження маси речовин. 1.1. Натрій нітрит, який використовують для консервування м’яса, одержують під час прожарювання NaNO3. Визначте масу натрій нітрату, необхідну для одержання 138 г NaNO2.
Дано : Розв’язання 1.2. Для газування напоїв використовують карбон (IV) оксид. Який об’єм вуглекислого газу (н.у.) можна одержати із 200 г CaCO3?
Дано: Розв’язання
Поиск по сайту: |
 Дано: х г 26 г
Дано: х г 26 г 112 г 98 г
112 г 98 г 
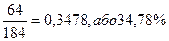 , w(S) =
, w(S) =  , w(СuS) =
, w(СuS) = 
 х =
х = 
 х =
х = 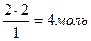
 ; М = 2Dн2; кг/моль, г/моль;
; М = 2Dн2; кг/моль, г/моль; ; n =
; n =  , моль;
, моль; , м3/моль, л/моль;
, м3/моль, л/моль; -
- , звідки
, звідки  ;
;  .
. : Мекв.(Н2SO4)=
: Мекв.(Н2SO4)=  Мекв.(основи)=
Мекв.(основи)=  : Мекв.(Fe(ОН)3 =
: Мекв.(Fe(ОН)3 = 
 : Мекв.(солі)=
: Мекв.(солі)=