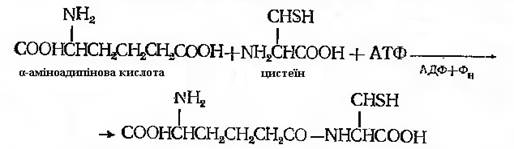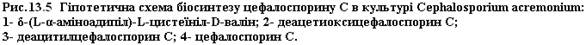|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Тема 21. Синтез пеніцилінів та цефалоспоринів⇐ ПредыдущаяСтр 11 из 11
21.1 Пеніциліни
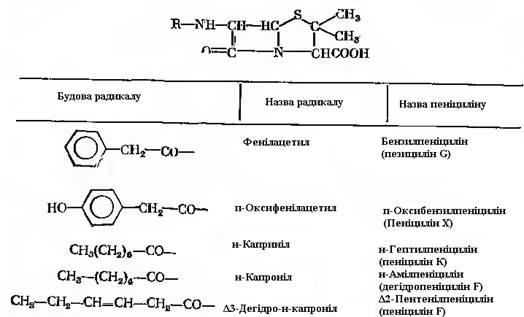
Одним з найбільш відомих і розповсюджених продуктів мікробіологічного синтезу є пеніциліни, група антибіотичних речовин, які мають однакове для всіх ядро і різноманітні замісники. Ядро представляє собою 6-амінопеніциланову кислоту, структуру якої складають 2 амінокислоти: цистеїн і валін. Боковий радикал за допомогою пептидного зв’язку приєднаний до β-лактамного кільця, вуглець-містка частина якого сформована із залишків цистеїну. Формально β-лактам є кето-похідним триметилениміну. Розрізняють пеніциліни за радикалами (табл. 21.1). Пеніциліни здатні синтезувати багато культур грибів. Ведуче місце належить мутантним штамам, що отримані із Pen. chrysogenum. Окрім природних радикалів, синтезувати які здатний сам продуцент в процесі ферментації, відомі так звані напівсинтетичні пеніциліни. Вони представляють собою похідні 6-амінопеніциланової кислоти з різноманітними ацильними радикалами, які відрізняються від природних, введення яких в молекулу здійснюється шляхом хімічного чи ензиматичного синтезу. Механізм біосинтезу молекули пеніцилінів. Культури, що продукують пеніциліни, можуть одночасно синтезувати сполуки з різноманітними замісниками. Однак ряд технологічних прийомів, що основані на знанні біохімічних механізмів біогенезу молекули, дозволяє отримувати продукти з радикалами, що забезпечують препарату необхідні якості. Деталі біогенезу пеніцилінів до кінця не встановлені. Відомо, що в міцелію продуценту міститься ізопеніцилін N, найбільш вірогідний метаболічний попередник різноманітних пеніцилінів. Він представляє собою трипептид: δ-(1-α-аміноадипіл)-L-цистеїніл-D-валін. Ензима-тичний механізм біогенезу молекули ізопеніциліну N детально не вивчений, тому приходиться користуватися відомими аналогіями.
Таблиця 21.1 – Структура радикалів пеніцилінів
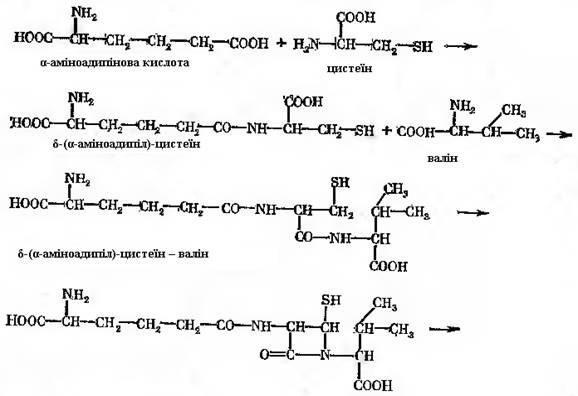
Описано декілька ферментних систем, які без рибосом здійснюють синтез сполук пептидної природи. Зокрема, добре вивчена система синтезу трипептиду глутатіону (глутамінілцистеїнілгліцин). У випадку синтезу глутатіону на першому етапі приймає участь γ-глутамілцистеїнсинтетаза. При синтезі пеніциліну фермент не ідентифікований, однак є підстави вважати, що реакція йде схожим образом, тільки замість глутамінової кислоти бере участь α-аміноадипінова. Є припущення, що є специфічна ферментна система δ-аміноадипінилцистеїн – синтетаза. Реакція протікає за участю АТФ.
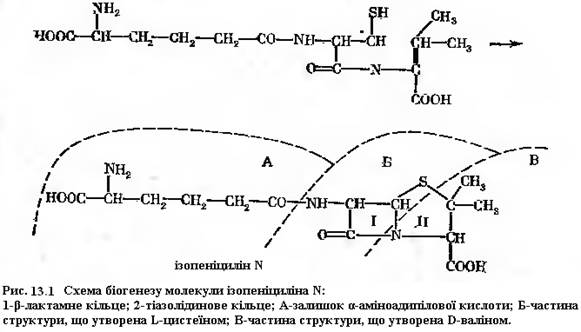
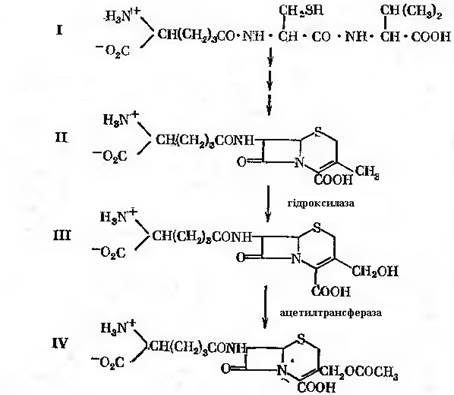
Наступна реакція ензиматичного приєднання L-валіну до дипептиду детально не описана. В приведеному вище випадку з глутатіоном в якості проміжної сполуки перед приєднанням гліцину утворюється фосфорильоване похідне трипептиду [δ-(α-амінодипиніл)-цистеїнілваліну] – попередника пеніциліну – реакція протікає подібним чином. Реакція описана на основі дослідів з грубим ферментним препаратом із міцелію продуценту пеніциліну. Для приєднання L-валіну до дипептиду були необхідні АТФ, фосфоенолпіруват і піруваткіназа. Присутність двох останніх, можливо, була обумовлена тим, що ферментний препарат не був гомогенним. Ферментна система отримала назву δ-(α-аміноадипіл)-цистеїн-валін-синтетаза. Далі в трипептиді відбувається дегідрування, в результаті виникає β-лактамне кільце, потім утворюється подвійний зв'язок. Наявність подвійного зв’язку забезпечує виникнення нової структури – тіазолідинового кільця. В цій структурі валін набуває D-конфігурації. На якому певному етапі відбувається перетворення L-валіну в D-ізомер, напевно не відомо. Відсутні також достовірні дані про, здавалось би, очевидний етап відщеплення α-аміноадипінової кислоти і заміни її на інший радикал (рис. 21.1). Синтез пеніциліну гальмує висока концентрація лізину, що присутня в метаболічному фонді продуцента. Можливо, що цей ефект обумовлений інгібуючою дією лізину на синтез α-аміноадипінової кислоти, що є його метаболічним попередником. Працює механізм регуляції за принципом зворотного зв’язку.
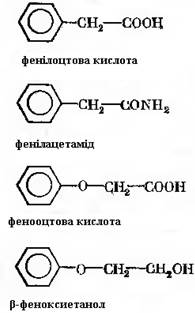
Із природних пеніцилінів найбільшу терапевтичну дію має бензилпеніцилін. Технологічним прийомом, що забезпечує синтез пеніциліну з потрібним радикалом, є ферментація з метаболічним попередником. При цьому в середовище вводять сполуку, дуже близьку за структурою до радикалу. Сполуки, які повністю або з незначними змінами входять із поживного середовища в молекулу антибіотика, називають попередниками. Для отримання бензилпеніциліну в середовище для ферментації звичайно вводять фенілоцтову кислоту або фенілацетамід. При біосинтезі феноксиметилпеніциліну (пеніциліну 5) попередником бокового ланцюга молекули можуть бути β-феноксиетанол і феноксиоцтова кислота:
Напівсинтетичні пеніциліни. Окрім пеніцилінів, що отримують шляхом ферментації з попередником, існують так звані напівсинтетичні пеніциліни. Арсенал їх досить великий. Основні переваги цих пеніцилінів у порівнянні з природними полягають в стійкості при різноманітних інтервалах рН, здатності пригнічувати антимікробний спектр. Для отримання напівсинтетичних пеніцилінів попередньо ведуть ферментацію з попередником, наприклад фенілацетамідом. Із отриманого бензилпеніциліну шляхом ферментативного гідролізу отримують кислоти 6-амінопеніциланову і фенілоцтову (рис. 21-2). Фермент, що здійснює дану реакцію, має назву пеніцилінамідаза, пеніцилін – амідогідролаза або ацил-КоА: 6-амінопеніциланова кислота ацилтрансфераза. За механізмом дії фермент є ацилазою. Він володіє зворотністю дії, здійснюючи в залежності від величини рН реакцію гідролізу або ацилування, – переносу ацильного угрупування. Завдяки ацилазі відбувається приєднання радикалу як при ферментації пеніциліну, так і при отриманні напівсинтетичних пеніцилінів. До ацилування утворюється КоА-похідне. Наприклад, при отриманні бензилпеніциліну в реакцію вступає феніл ацетил-КоА.
Рисунок 21.2 – Схема ферментативного гідролізу
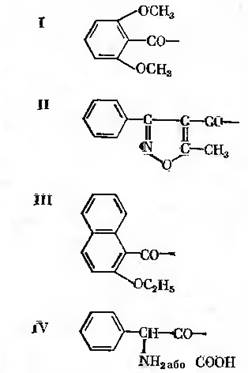
Ацилази широко зустрічаються у мікроорганізмів, бо ацилювання є однією із найбільш розповсюджених анаболічних реакцій. Вони можуть мати різну локалізацію, проявляти активність в різних інтервалах рН, відрізнятися специфічністю відносно субстратів ацилювання або ацильного угрупування. В якості ферментного препарату часто використовують суспензію мікробних клітин, що несуть дану активність. Необхідною умовою, що пред’являється до суспензій, так само і до ферментного препарату, є відсутність активності пеніцилінази. Остання представляє собою β-лактамазу, що руйнує β-лактамазне кільце. В результаті його руйнування молекула речовини втрачає антибіотичну активність. Ферментний препарат може бути іммобілізований на носії і поміщений в колонку. При відповідних технологічних режимах, коли в систему вводять 6-амінопеніциланову кислоту і майбутній замісник, відбувається ферментативний синтез. В якості замісників звичайно використовують β-похідні аліфатичних кислот. До числа найбільш відомих напівсинтетичних пеніцилінів відносять стійкі до стафілококової пеніцилінази: метицилін, оксацилін, нафцилін; антибіотик широкого спектру дії, активний проти грамнегативних організмів, ампіцилін (рис. 13-3).
Рисунок 21.3 – Радикали напівсинтетичних пеніцилінів Широка розповсюдженість ацилаз в мікробному світі примушує сумніватися, що всі описані нині пеніцилінамідогідролази мають вузьку специфічність стосовно до гідролізу похідних 6-амінопеніциланової кислоти. Про це ж можуть свідчити відмінності в молекулярних масах ферментів. Так, ацилаза із E. coli має молекулярну масу 70000, із Bac. megaterium – 120000, Fusarium semitectum – 65000, Kluyvera citrophila – 63000. Ферментидругого типу, що синтезуються бактеріальними культурами, частіше застосовуються на практиці. Найбільш вивчений фермент E. сoli. В її клітинах фермент розташований в перилазматичному просторі, тобто між клітинною стінкою і цитоплазматичною мембраною. Гідролітичну функцію фермент здійснює при рН 7,8 – 8,0, синтетазну – при рН 5,0 – 5,5. оптимальна температура 45 – 50˚С. При вивченні синтетазної дії ферменту було показано, що швидкість реакції ацилювання 6-амінопеніциланової кислоти значно збільшиться при використанні заміщених карбонових кислот типу R – CO – NH – R1 або R – CO – SR1, зокрема похідних з гліцином і тіогліколевою кислотою, наприклад фенилацетилгліцин, фенілацетил-тіогліколева кислота. При гідролізі окрім бензилпеніциліну бактеріальні ферменти легко гідролізують різноманітні N-фенілацетил-похідні L-амінокислот. Вважають, що фермент має велику спорідненість до N-фенілацетильної групи, ніж до 6-амінопеніциланової кислоти. При вирощуванні продуцентів пеніцилінамідогідролаз необхідно мати на увазі, що активність культури істотно збільшується, якщо в середовище вводити фенілоцтову кислоту. Введення феноксиоцтової кислоти має аналогічний ефект, але рівні активності дещо нижчі. Пригнічення синтезу ферменту відбувається при температурі культивування вище 37˚С. Пригнічують синтез високі концентрації розчиненого кисню у середовищі. Характерною особливістю пеніцилінамідогідролази E. сoli є регуляція її синтезу за допомогою механізму катаболітної репресії. Абсолютним репресором синтезу є глюкоза, ацетат частково репресує синтез. Репресуючий ефект повність знімає циклічний 3`,5`-аденозинмонофосфат. Ферментація пеніциліну. Продуцентами пеніциліну служать гриби роду Penicillium. На даний момент практично скрізь використовують мутантні штами Penicillium chrysogenum. Для ферментації пеніциліну звичайно споживають середовища, до складу яких входять кукурудзяний екстракт, глюкоза або гідрол, лактоза або технічний напівфабрикат у вигляді сиропу. Із мінеральних компонентів в середовища вводять солі амонію, тіосульфат, фосфати калію чи натрію, солі магнію, марганцю, цинку, натрію і т.д. Для регулювання рН у ході ферментації в середовище вносять СаСО3. Окрім вказаних компонентів для спрямованого біосинтезу пеніциліну з певним радикалом до складу середовища вводять попередник. Середовище для ферментації відрізняється від середовища для отримання посівного матеріалу. Основна відмінність останнього від середовища для ферментації – відсутність або менша концентрація лактози, деяких мінеральних компонентів і попередників. Динаміка кількісної зміни компонентів середовища на фоні росту біомаси і накопичення в середовищі пеніциліну показана на рис. 13.4. На початковому періоді росту культури відбувається інтенсивне включення в метаболізм глюкози і молочної кислоти, що міститься в кукурудзяному екстракті. Асиміляція лактози не відбувається. Швидко асимілюється азот мінеральних та органічних компонентів середовища. Інтенсивний синтез антибіотику починається наприкінці логарифмічної фази росту міцелію. Дещо раніше, коли концентрація глюкози стане незначною, культура починає використовувати лактозу. Вважають, що асиміляція лактози в присутності глюкози неможлива внаслідок того, що має місце катаболітна репресія. Як було відмічено вище, в середовища звичайно вводять метаболічний попередник радикалу молекули пеніциліну. Речовинами, що ефективно включаються в молекулу пеніциліну, є, як правило, різноманітні β-замісники оцтової кислоти; α-метиленова група оцтової кислоти при цьому повинна бути вільною. Попередники, що використовуються при біосинтезі бензилпеніциліну і феноксиметил-пеніциліну, окрім основного їх призначення – формування радикалу – можуть включатися в обмін речовин і використовуватися продуцентом як джерело живлення.
У зв’язку з цим бажано мати у якості попередників такі сполуки, які піддавалися би активному ферментативному руйнуванню продуцентом. В окремому випадку при синтезі бензилпеніциліну краще застосовувати фенілацетамід, а не фенілоцтову кислоту, бо остання достатньо швидко піддається окисленню; фенілацетамід окислюється більш повільно. Попередньо відбувається його дезамінування до утворення фенілоцтової кислоти, яка потім входить до складу молекули бензилпеніциліну.
21.2 Цефалоспорини
Близькими до пеніцилінів за хімічною природою і механізмами біосинтезу є цефалоспорини. Найбільш характерним природнім продуктом може бути названий цефалоспорин С:
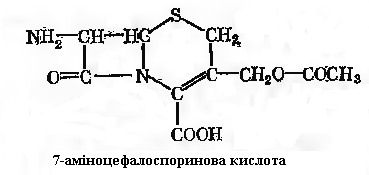
Цефалоспорини синтезуються переважно грибами, що відносяться до роду Cephalosporium. Особливо цінними вони є в тих випадках, коли патогенна мікрофлора резистентна до пеніцилінів. Цефалоспорини мають загальні з пеніцилінами шляхи біосинтезу. Як і при біосинтезі пеніцилінів, вихідним трипептидом є δ-(α-аміноадипініл)-цистеїнілвалін. На одному із етапів синтезу відбувається утворення тіазолідкіового кільця (у випадку пеніцилінів) або дигідрогіазинового (у випадку цифалоспоринів). Далі йде реакція гідроксилювання, після чого сполука, що утворюється піддається ферментативному ацетилюванню. На заключному етапі L-аміноадипінова кислота приймає D-конфігурацію (рис. 13-5). Цефалоспорин С, як і бензилпеніцилін, піддається ферментативному гідролізі пеніцилінамідогідролазою. Продуктами гідролізу є D-α-аміноадипінова і 7-аміноцефалоспоринова кислоти. Остання може слугувати субстратом N-ацилювання:
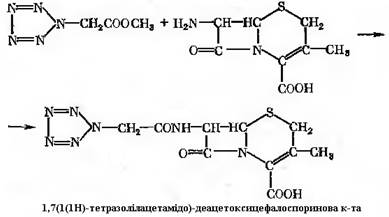
Ензиматичний гідроліз можуть здійснювати ферменти різноманітних мікроорганізмів. Деякі з них, наприклад в культурі, Kluyvera citrophila, здатні вести гідроліз в лужному інтервалі рН, а ацилювання – в кислому. Окрім 7-аміноцефалоспоринової кислоти субстратом ацилювання може бути 7-аміно-деацетоксицефалоспоринова кислота:
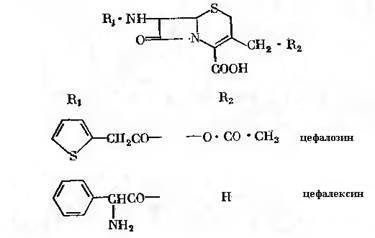
Напівсинтетичні цефалоспорини можуть бути отримані ферментативним методом, як і напівсинтетичні пеніциліни:
Контрольні питання: 1. Охарактеризувати механізм біосинтезу молекули пеніцилінів 2. Розкрити механізм напівсинтетичних пеніцилінів, їх особливі властивості 3. Охарактеризувати особливості ферментації пеніцилінів 4. Розкрити особливості біосинтезу цефалоспоринів
Перелік посилань 1. Безбородов А.М. Биохимические основы микробиологического синтеза. – М.: Легкая и пищевая пром-сть, 1984.- 304 с. 2. Филипович Ю.Б. Основы биохимии: Учеб. для хим. и биол. спец. пед.. ун-тов и ин-тов.- 4-е узд., перераб. и доп. – М.: узд-во «Агар», 1999.- 512 с: ил.
Навчальне видання Конспект лекцій з дисципліни „Біохімічні основи мікробного синтезу” для студентів денної та заочної форм навчання напряму 6.051401 „Біотехнологія”
Укладачі: Філімоненко Д.В.
Підписано до друку______________20__р. Формат________________ Обсяг_________________ Тираж______________ екз. Заказ_________________ 51918, м. Дніпродзержинськ, вул. Дніпробудівська,2
Поиск по сайту: |