 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Требования к исходным веществамСтр 1 из 5Следующая ⇒
Титрованные растворы, назначение. Титр, титр по определяемому веществу. Требования к исходным веществам. Определение поправочных коэффициентов титрованных растворов. Титрованные растворы — растворы точно известной концентрации, применяемые в титриметрическом анализе. Их применяют в титриметрии как стандартные растворы для количественного определения тех или иных веществ и для установки титров других растворов. Титр - концентрация раствора, выраженная количеством(в граммах) растворённого вещества в 1 мл раствора или количеством какого-либо вещества,реагирующего с 1 мл данного раствора. Титр по определяемому веществу или условный титр — масса какого-либо вещества (в граммах), реагирующая с одним миллилитром данного раствора. Иными словами: масса определяемого вещества, оттитровываемая одним миллилитром раствора. Рассчитывается по формуле: где
Условный титр и титр по растворённому веществу связаны следующей формулой:
где
Требования к исходным веществам.
Вещество должно быть химически чистым, т. е. не должно содержать посторонних примесей в таких количествах, которые могут повлиять на точность анализов (не более 0,05—0,1%). Состав вещества должен строго соответствовать формуле.
Желательна возможно большая величина грамм-эквивалента вещества, что позволяет увеличить точность установления нормальности раствора. Удовлетворяющие указанным требованиям вещества называются исходными или стандартными, так как пользуясь ими, устанавливают титры всех остальных веществ.
1.8.1. При применении установочного вещества коэффициент поправки вычисляют по формуле
- молярная масса эквивалента установочного вещества, г/моль; - заданная молярная концентрация вещества в растворе, моль/дм ; - объем анализируемого раствора, израсходованный на титрование, см . Расчет факторов и молярной массы эквивалентов для различных типов химических реакций. Расчетные формулы для определения концентрации (в процентах) субстанции в лекарственных веществах (прямое, обратное титрование, титрование с постановкой контрольного опыта) приведите примеры. Эквивалентная масса — это масса одного эквивалента данного вещества. Эквивалентная молярная масса вещества[править | править вики-текст] Молярная масса эквивалентов обычно обозначается как Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества.
Фактор эквивалентности[править | править вики-текст] Отношение эквивалентной молярной массы к его собственной молярной массе называется фактором эквивалентности (обозначается обычно как Число эквивалентности[править | править вики-текст] Число эквивалентности Например, в реакции:
Эквивалентом является мнимая частица
Прямое титрование
Обратное титрование
№3. Перманганатометрия- метод, который основан на окислительной способности рабочего раствора перманганата калия KМnO4. Титрование ведется без индикатора. Применяется для определения только восстановителей при прямом титровании. Титр: KMnO4(кислая среда) Инд.: сам титрант 5H2O2+ 2KMnO4+3H2SO4=2MnSO4+K2SO4+5O2+8H2O МnО4- + 8Н+ + 5е = Мn2+ + 4Н2О H2O2-2e=O2+2H+ T=MfxCтитра/1000 W%=(VxKxT/m)x100% Иодиметрия- метод, в котором рабочим титрованным раствором служит раствор свободного иода в КI3. Прямой метод позволяет определять восстановители. Индикатором служит крахмал. As3+ + I2=As5+ +2HI T=MfxCтитра/1000 W%=(VxKxT/m)x100% Обратный метод позволяет определять окислители. Индикатором служит крахмал. Титрант: I2 и Na2S2O3 I2+ 2Na2S2O3= 2NaI+ Na2S4O6 T=MfxCтитра/1000 W%=((V1xK1)x(V2xK2)xT)/mx100% Броматометрия основана на использовании в качестве титранта бромата калия KBr. при определении восстановителей.(соединений мышьяка) Индик.: метиловый красный, метиловый оранж. 3As3+ +(BrO3)- +6H+ = 3As 5+ + Br- +3H2O fэкв=1/4 T=MfxCтитра/1000 W%=(VxKxT/m)x100% Цериметрия- метод определения восстановителей, основанный на применении стандартных растворов соединений церия Ce(SO4)2 Индикатор: дифиниламин или о-фенантролин Ce4+ +e=Ce3+ 2FeSO4+ 2Ce(So4)2=Fe2(SO4)3 + +Ce2(SO4)3
2- + Fe2+= Fe
3 T=MfxCтитра/1000 W%=(VxKxT/m)x100%
Обратная: 2Ce(SO4)2+2KI=I2+Ce2(SO4)3+K2SO4 I2+2Na2S2O3=2NaI+Na2S4O6 T=MfxCтитра/1000 W%=(VxKxT/m)x100% Для вычисления молярной массы эквивалента окислителей или восстановителей учитывается число электронов, принимающих участие в окислительно-восстановительной реакции (Мэ = М/ne, где n - число электронов е). Для определения числа электронов необходимо знать начальную и конечную степень окисления окислителя и восстановителя.
№7 Получение. Натрия гидрокарбонат образуется как промежуточный продукт при получении кальцинированной соды Na2C03. Для этого концентрированный раствор поваренной соли насыщают аммиаком при охлаждении и одновременно под давлением пропускают через него углекислый газ: NH3 + С02 + Н20 — NH4HC03 Гидрокарбонат аммония реагирует далее с поваренной солью с образованием хлорида аммония и натрия гидрокарбоната: NH4HC03 + NaCl — NH4C1 + NaHC03 Менее растворимый в воде натрия гидрокарбонат выпадает в осадок, который отделяют фильтрованием. Питьевая сода может быть получена при насыщении кристаллогидрата Na2C03- 10Н2О углекислым газом. После перекристаллизации из воды, насыщенной углекислотой, выделяется чистый препарат, применяемый в медицине. Определение подлинности. Подлинность препарата устанавливают по окрашиванию пламени горелки в желтый цвет (Na+) и по выделению С02 при действии соляной кислоты: NaHC03 + НС1 — NaCl + C02f + Н20 Чрезвычайно важно уметь быстро отличать натрия карбонат от натрия гидрокарбоната, учитывая сходство их физических и химических свойств. Наиболее простой способ — добавление индикатора фенолфталеина к раствору испытуемой соли. При этом растворы карбонатов с концентрацией 0,1 моль/л окрашиваются в малиновый цвет, а раствор натрия гидрокарбоната остается бесцветным или становится слабо-розовым, так как интервал рН перехода окраски индикатора 8,2 — 10,0 (см. рис. 4.1). Согласно БФ идентификацию солей проводят следующим образом. К 5 мл 5,0 % раствора препарата в воде, свободной от углекислого газа, добавляют ОД мл разбавленного раствора фенолфталеина. Наблюдают бледно-розовую окраску. При нагревании вследствие гидролиза выделяется газ и раствор становится красным (увеличивается значение рН раствора): Н+ НСОз + Н20 — С02Т + ОН" + Н20 Испытания на чистоту. Согласно ГФ в ЛС недопустимыми примесями являются соли аммония, тяжелые металлы, а допустимыми — хлориды, сульфаты, железо, калий, мышьяк, содержание которых оценивается с использованием эталонов. Для обнаружения примеси солей аммония необходимо к 10 мл 5,0% раствора препарата добавить реактив Несслера. Содержание иона аммония в эталонном растворе 1 мкг/г. В течение 5 мин не должна появиться желтая окраска большей интенсивности, чем в пробе с эталонным раствором. Примесь мышьяка не должна превышать 2 мкг/г. Количественное определение. Содержание NaHC03 в ЛС определяют методом нейтрализации. Титрование проводят хлористоводородной кислотой в присутствии метилового оранжевого. При рН 3,1 — 4,0 происходит изменение окраски индикатора с желтой на красную. Один мл раствора хлористоводородной кислоты концентрацией 1 моль/л эквивалентен 0,0840 г NaHC03. Лития карбонат Определение подлинности. Для идентификации ЛС возможны следующие реакции: пламя горелки окрашивается в карминово-красный цвет солью лития, смоченной соляной кислотой; с водородфосфат-ионом (гидрофосфатом натрия Na2HP04) в нейтральной или слабощелочной среде растворимые соли лития дают белый осадок лития фосфата: 3Li+ + НРО4" + ОН" — Li3P044 + Н20 Для более полного осаждения лития фосфата в реакционную смесь добавляют этанол; ионы Lf с оксихинолином образуют красный оксихинолинат лития C9H6NOLi, при УФ-облучении которого наблюдается голубая флуоресценция; реакция на карбонат-ион с хлористоводородной кислотой сопровождается выделением углекислого газа: Li2C03 + 2НС1 — 21ЛС1 + Н20 + С02Т Для определения подлинности можно использовать следующую методику: 0,2 г препарата растворяют в соляной кислоте, выпаривают до сухого остатка на водяной бане, остаток (LiCl) растворим в 3 мл этанола (96 %). Испытания на чистоту. В зависимости от способов применения препарата выпускается «чистый», «химически чистый» лития карбонат, а также препарат с маркировкой «годен для инъекций». После стерилизации растворов препарата лития карбоната для инъекций наблюдается помутнение. Это вызвано возможным содержанием примесей ионов кальция, магния, цинка, которые осаждаются из растворов в виде карбонатов. В соответствии с БФ прозрачность (мутность) и цветность оценивают, действуя азотной кислотой на суспензию, приготовленную смешиванием 10 г препарата в 30 мл воды. Раствор нейтрализуют раствором натрия гидроксида концентрацией 2 моль/л и разбавляют дистиллированной водой до объема 100 мл. Раствор должен быть прозрачным и бесцветным. Допустимые примеси не должны превышать содержание в эталонах: мышьяка — 2 мкг/г, кальция — 200 мкг/г, тяжелых металлов — 2 мкг/г, свинца, железа — 20 мкг/г, магния — 150 мкг/г. Количественное определение. Используют метод обратного титрования, индикатор — метиловый оранжевый: Li2C03 + 2НС1 — 21ЛС1 + Н20 + С02Т НС1 + NaOH — NaCl + Н20 Один миллилитр раствора хлористоводородной кислоты концентрацией 1 моль/л эквивалентен 0,03695 г лития карбоната. Содержание лития карбоната в лекарственном веществе должно составлять 98,5-100,5%.
4.Количественное определение галогенидов - Аргентометрия. Аргентометрические методы анализа относятся к методам осаждения, которые нашли мировое применение для анализа лекарственных средств. Аргентометрию используют для анализа роданидов, хлоридов, бромидов, йодидов щелочноземельных металлов и органических оснований. Сущность аргентометрических методов заключается в выделении определяемого вещества в виде трудно растворимых осадков солей серебра. Для определения точки эквивалентности в зависимости от ph среды в аргентометрии применяют ряд индикаторов: K2CrO4 - 5% раствор хромата калия; NH4Fe(SO4)2 . 12H2O - насыщенный раствор железо - аммонийных квасцов, подкисленный азотной кислотой; Адсорбционные индикаторы: эозинат натрия, бромфеноловый синий, флуоресцеин; Свежеприготовленный раствор крахмала; Нитрозо - крахмальная бумага. Метод Мора.Прямая аргентометрия. Только для Cl–, Br–; (не исп для I–). Титрант – AgNO3, индикатор – K2CrO4, среда: pH=6–8. NaBr + AgNO3 → AgBr↓ + NaNO3, K2CrO4 + 2AgNO3 → Ag2CrO4↓ + 2KNO3. fэкв(NaBr)=1, Метод Фаянса.Прямая аргентометрия. Титрант – AgNO3, индикаторы – эозинат натрия (Br–,I–), бромтимоловый синий (Cl–), среда – CH3COOH (30%).
NaI + AgNO3 → AgI↓ + NaNO3. Йодид серебра адсорбирует на себе одноименные ионы; появляется ярко-розовая окраска: {m(AgI)∙nI–(n–x)K+}x– В точке эквивалентности коллоидная частица становится электронейтральной, в КТТ начинает адсорбировать Ag+; идет перезарядка мицеллы, осадок коагулирует, раствор просветляется: {m(AgI)∙nI–(n–x)K+}x–∙xAg+, {m(AgI)∙nI–(n–x)K+}x–∙xAg+ + Ind2– → (x/2)Ag2Ind + {m(AgI)∙nI–(n–x)K+}x–. fэкв(NaI)=1, Метод Фольдгарда.Обратная аргентометрия. Титранты – 1) AgNO3, 2) NH4SCN; Индикаторы – NH4Fe(SO4)2 (Cl–, Br–), FeCl3 (I–); Среда – HNO3 (pH=3). К раствору навески препарата прибавляют HNO3, точный избыточный объемAgNO3 и индикатор: KBr + AgNO3 → AgBr↓ + KNO3, AgNO3 + NH4SCN → AgSCN↓ + NH4NO3; В КТТ индикатор взаимодействует с титрантом: 3NH4SCN + NH4Fe(SO4)2 → Fe(SCN)3 + 2(NH4)2SO4. fэкв(KI)=1, Преимущества пред другими методами: 1. Сильнокислая среда, 2. Не мешают другие ионы; Недостатки: 1. Меньшая точность (обратный метод),
Тиоцианатометрия – это метод осадительного титрования, который базируется на использовании реакций образования труднорастворимых тиоцианатов. Титрант: аммоний или калий тиоцианат NH4SCN, KSCN - вторичные стандартные растворы. Стандартизация: за стандартным раствором AgNO3: AgNO3 + NH4SCN = AgSCN¯ + NH4NO3. Индикатором при стандартизации аммоний или калий тиоцианата есть соли ферума (ІІІ): Fe3+ + SCN- = [Fe(SCN)]2+ Титруют до появления слабо розовой окраски. Среда: нитратнокислая. Индикатор метода:соли ферума (ІІІ) NH4Fe(SO4)2×12H2O в присутствии нитратной кислоты. Определяемые вещества: лекарственные средства, которые содержат аргентум (протаргол, коларгол, аргентум нитрат). При анализе препаратов, которые содержат неионное серебро, предварительно переводят серебро (Ag) в ионное состояние, обрабатывая препарат сульфатной, нитратной кислотами при нагревании. !!! При определении йодидов индикатор прибавляют в конце титрования, во избежание параллельной реакции: 2Fe3+ + 2I- = 2Fe2+ + I2. Преимущества тиоцианатометрии – возможность титрования: · в очень кислых растворах; · в присутствии многих катионов, которые мешали при определении по методу Мора (катионы бария, плюмбума и др., которые образовывали окрашенные осадки хроматов).
Меркурометрия. Меркурометрия – это метод осадительного титрования, который базируется на использовании реакций образования труднорастворимых осадком солей меркурия (І) Hg22+:
2Cl- + Hg22+ = Hg2Cl2¯ ПР = 1,3×10-18 2I- + Hg22+ = Hg2I2¯ ПР = 4,5 ×10-29
Титрант: втор. станд. раствор Hg2(NO3)2. Стандартизация: за стандартным раствором NaCl: Hg2(NO3)2 + 2NaCl = Hg2Cl2¯ + 2NaNO3 Индикаторы: 1) раствор ферум (ІІІ) тиоцианата (от красного до обесцвечивания) 2Fe(SCN)2+ + Hg22+ = Hg2(SCN)2¯ + 2Fe3+.; 2) 1-2 % спиртовый раствор дифенилкарбазона (до появления синей окраски). !!! Для учета объема титранта, который израсходовано на титрование индикатора титруют “слепую пробу”:
2)!!! Индикатор прибавляют перед окончанием титрования, так как если его прибавить сначала, то может задолго до т.э. образоваться дифенилкарбазид меркурия (ІІ) и дать синюю окраску скорее, чем будет оттитрован галогенид. Определяемые вещества: хлориды и йодиды. Среда: очень кислая (может быть до 5 моль/л ионов H+). Преимущества меркурометрии сравнительно с аргентометрией: 1. Возможность титрования в очень кислых растворах. 2. Титрант более дешевый. 3. Соли Меркурия (І) являются более нерастворимые, поэтому точность и чувствительность титрования высшие, а скачок титрования на кривой значительно больше. 4. Возможность проведения титрований с индикатором дифенилкарбазоном в мутных и окрашенных растворах. 5. Возможно реверсивное титрование солей Меркурия (І) .
Поиск по сайту: |
 ,
,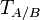 — титр раствора вещества A по веществу B (в г/мл);
— титр раствора вещества A по веществу B (в г/мл); — масса вещества B, взаимодействующего с данным раствором (в г);
— масса вещества B, взаимодействующего с данным раствором (в г); — объём раствора вещества A (в мл).
— объём раствора вещества A (в мл). ,
, и
и  — молярные массы эквивалентов веществ A и B соответственно.
— молярные массы эквивалентов веществ A и B соответственно. ,
, или
или  .
.
 ).
). представляет собой небольшое положительное целое число, равное числу эквивалентов некоторого вещества, содержащихся в 1 моль этого вещества. Фактор эквивалентности
представляет собой небольшое положительное целое число, равное числу эквивалентов некоторого вещества, содержащихся в 1 моль этого вещества. Фактор эквивалентности 

 . Число
. Число  есть фактор эквивалентности,
есть фактор эквивалентности,  .
.


 .
.
 .
. .
.