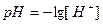|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Задания по теме 1 «Решение уравнений»
1. Найдите все корни уравнения с абсолютной погрешностью не хуже 10-8
2. Найдите корни уравнения с абсолютной погрешностью не хуже 10-8
3.
4. Найдите корни уравнения
5. Найдите корень уравнения на отрезке [0,5] с точностью до 6 значащих цифр:
6. Температура кипения раствора бензола в толуоле (t) зависит от массовой доли бензола следующим образом:
(ω, % –массовая доля бензола в жидкости). a = 110.9, b = -0.35, c = 0.001, d = -0.00099, e = -2.24 Каков должен быть состав жидкости (доля бензола и толуола), чтобы температура ее кипения была 96.7℃? 7. Зависимость теплоемкости метана от температуры описывается уравнением
С точностью до тысячных долей градуса определите температуру, при которой теплоемкость метана составит 60,1 a = 160.1, b = 0.181, c = -6.02∙10-5, d = -69.92. 8. Найдите все действительные корни уравнения:
9. Найдите все действительные корни уравнения с абсолютной погрешностью не менее 1∙10-8
10. Массовая доля бензола в равновесном паре над жидкой смесью (ω, %) бензол-толуол в зависимости от его массовой доли в растворе (x, %) подчиняется уравнению:
a = -3.9∙10-7, b = 3.9∙10-4, c = -0.023, d = 2.26, e=0. При каком составе жидкости содержание бензола в паре составит 80.5%?
Практическая работа №2. Решение нелинейных уравнений в системе Mathcad Нахождение корней нелинейных уравнений в системе Mathcad Задача нахождения корней нелинейного уравнения при определении рН водных растворов
Теоретическая часть Распад электролитов на ионы при растворении их в воде называется электролитической диссоциацией.
Для объяснения особенностей водных растворов электролитов шведским химиком С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации. Основные положения теории следующие: 1. Электролиты при растворении в воде распадаются на ионы – положительные и отрицательные. Ионы находятся в более устойчивых электронных состояниях, чем атомы. Среди таких ионов встречаются простые, например, Na+, Mg2+, Al3+ и сложные, состоящие из нескольких атомов, например, NO3-, SO42-, PO43-. В растворе ионы беспорядочно передвигаются в различных направлениях. 2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные – к аноду. Первые называются катионами, а вторые анионами. 3. Диссоциация – обратимый процесс. Одновременно с распадом молекул на ионы протекает обратный процесс – соединения ионов в молекулу. Поэтому в уравнениях электролитической диссоциации стоит не знак равенства, а знак обратимости ↔. Например, уравнение диссоциации молекулы электролита КА на катион К+ и анион А- записывается в виде КА Теория электролитической диссоциации полностью согласуется с атомно-молекулярным учением и теорией строения атома. Под степенью диссоциации электролита понимается отношение числа диссоциированных на ионы молекул n к общему числу молекул растворенного электролита N, то есть
Если степень диссоциации мала, то раствор является слабым электролитом. В слабых электролитах диссоциация происходит не полностью. В их растворах устанавливается равновесие между недиссоциированными молекулами и продуктами их диссоциации. Поскольку в растворах слабых электролитов процесс диссоциации протекает обратимо, то к нему может быть применен закон действующих масс. Так, для процесса диссоциации уксусной кислоты можно записать
Константа равновесия КС определяется выражением:
В соответствии с принципом Ле Шателье температурная зависимость КD указывает на то, что процесс диссоциации является экзотермическим, то есть энергия гидратации ионов выше энергии внутримолекулярных связей. Константа диссоциации указывает на прочность молекул слабых электролитов в данном растворе. Чем меньше константа диссоциации в данном растворителе, тем слабее диссоциирует электролит и тем, следовательно, устойчивее его молекулы. В случае электролита
Для слабых электролитов, если принять, что
Получаем
Отсюда получаем, что
Это соотношение показывает, что при разбавлении раствора, а именно при уменьшении концентрации электролита Если в растворе электролита
Очевидно, что с увеличением силы кислоты константа В растворах многоосновных кислот, а также оснований, содержащих несколько гидроксильных групп, устанавливаются ступенчатые равновесия, отвечающие последовательным стадиям диссоциации. Например, диссоциация ортофосфорной кислоты протекает в три ступени
Каждой из этих ступеней отвечает определенное значение ступенчатой константы диссоциации. Поскольку Водородный показатель Для характеристики кислотности (щелочности) среды введен специальный параметр – водородный показатель или рН. Водородным показателем или рН называют взятый с обратным знаком десятичный логарифм концентрации водородных ионов в растворе:
Водородный показатель определяет характер реакции раствора. Например, при 295К она нейтральна и рН=7 (концентрация ионов водорода равна [Н+]=10–7моль/л). При рН<7 (концентрация ионов водорода [Н+] >10–7моль/л) реакция раствора кислая, при рН>7 (концентрация ионов водорода [Н+] <10–7моль/л) – щелочная. С изменением температуры величина ионного произведения воды КW изменяется. Величина рН может служить критерием силы кислоты или основания. В ряду кислот будет сильной та, у которой при одинаковой молярной концентрации активность ионов Н+ выше (рН ниже). Для оснований подобная зависимость носит обратный характер.
Таблица
Поиск по сайту: |



 с точностью до 10 знаков после запятой.
с точностью до 10 знаков после запятой.






 К+ + А-
К+ + А-

 Константу равновесия для процесса диссоциации называют константой диссоциации КD. Как и любая константа равновесия, константа диссоциации зависит от природы диссоциирующего вещества. С увеличением температуры КD обычно уменьшается.
Константу равновесия для процесса диссоциации называют константой диссоциации КD. Как и любая константа равновесия, константа диссоциации зависит от природы диссоциирующего вещества. С увеличением температуры КD обычно уменьшается. , диссоциирующего на ионы
, диссоциирующего на ионы  и
и  , константа и степень диссоциации связаны соотношением, которое называется законом разбавления Оствальда
, константа и степень диссоциации связаны соотношением, которое называется законом разбавления Оствальда .
. ,
, .
. .
. , степень диссоциации электролита возрастает.
, степень диссоциации электролита возрастает. , то концентрации ионов
, то концентрации ионов  .
. возрастает.
возрастает. (
(  )
) (
(  )
) (
(  ).
). , то в наибольшей степени протекает диссоциация по первой ступени. При переходе к каждой последующей ступени степень диссоциации резко уменьшается.
, то в наибольшей степени протекает диссоциация по первой ступени. При переходе к каждой последующей ступени степень диссоциации резко уменьшается.