 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ГРАФИГІ МЕН ТАПСЫРУ МЕРЗІМІ 13 страница
9.6 сурет
Классикалық механикада екі атомды газдың молекуласын деформацияланбайтын, қатаң байланысқан екі материялық нүктелердің бірігуі ретінде қарастырады. Бұл жүйе ілгерілемелі қозғалыстың үш еркіндік дәрежесінен басқа айналмалы қозғалыстың екі еркіндік дәрежесіне де ие болады. Суретте б) жағдайы. Себебі, жүйе екі ось бойымен айналады, ал екі атом арқылы өтетін үшінші осьтен айналудың мағынасы жоқ деп есептелінеді, демек, молекуласы екі атомнан тұратын газдың бес еркіндік дәрежелері бар: і = 5. Үш атомды және көп атомды бейсызықты молекулалардың алты еркіндік дәрежелері бар: үшеуі ілгерілемелі және үшеуі айналмалы қозғалыстардікі деп есептелінеді, і = 6. Суретте в) жағдайы. Нақты газ молекулалары арасында қатаң байланыс жоқ, сондықтан нақты газ молекулалары үшін тербелмелі қозғалыстың да еркіндік дәрежелерін ескеру қажет. Жалпы санына байланыссыз молекуланың үш еркіндік дәрежесі әрқашанда ілгерілемелі қозғалыстікі. Ілгерілемелі қозғалыстың еркіндік дәрежелерінің бірінен бірінің артықшылығы жоқ, демек олардың әрқайсысына орташа есеппен
Классикалық статистикалық физикада энергияның еркіндік дәрежелеріне біркелкі бөліну заңын Больцманқорытып шығарды: термодинамикалық тепе-теңдік күйдегі статистикалық жүйенің әрбір ілгерілемелі және айналмалы қозғалысының еркіндік дәрежелеріне орта есеппен
мұндағы і= Идеал газ молекулалары өзара әсерлеспейді деп есептелінгендіктен молекулалар арасындағы өзара әсердің потенциялық энергиясы нульге тең. Демек, газдың бір молінің ішкі энергиясы
m массалы газ үшін ішкі энергия өрнегін жазайық:
мұндағы Идеал газдың жылу сыйымдылығы. Идеал газдың жылу сыйымдылығының молекула-кинетикалық теориясы және оның шектелуі. Меншікті жылу сыйымдылығы деп 1кг затты 1К температураға дейін қыздыру үшін қажетті жылу мөлшерін айтады
Меншікті жылу сыйымдылығының өлшем бірлігі – Дж/ кгК. Молярлық жылусыйымдылығы деп 1 моль затты 1 К температураға дейін қыздыруға қажетті жылу мөлшерін айтады:
Меншікті және молярлық жылусыйымдылықтарының арасындағы байланысты көрсететін өрнек: Тұрақты көлемде немесе тұрақты қысымда қыздырылған зат үшін тұрақты көлемдегі немесе тұрақты қысымдағы жылусыйымдылықтарын айырады. Термодинамиканың 1 заңын 1 моль газ үшін жазайық: Егер газ тұрақты көлемде қыздырылса, онда жұмыс нульге тең, сондықтан сырттан берілетін жылу мөлшері оның ішкі энергиясының көбеюіне жұмсалады: Ішкі энергия . Егер газ тұрақты қысымда қыздырылса, термодинамиканың 1 заңын пайдаланып, тұрақты қысымдағы жылусыйымдылықты табуға болады.
Ішкі энергия қысымға да, көлемге де тәуелді емес, тек температураға тәуелді екенін және
Бұл теңдеу тұрақты қысымдағы молярлық жылусыйымдылықтың тұрақты көлемдегі молярлық жылусыйымдылықтан универсал газ тұрақтысының шамасына артық екенін көрсетеді. Ол тұрақты қысымда газды қыздыру үшін газды ұлғайтуға қосымша жылу мөлшері керектігімен түсіндіріледі, себебі қысымды тұрақты ету үшін көлемді ұлғайту қажет. Тұрақты көлемдегі молярлық жылусыйымдылықтың өрнегін пайдаланып, тұрақты қысымдағы молярлық жылусыйымдылықтың еркіндік дәреже санына тәуелділігін аламыз: Термодинамикалық процестерде әр газ үшін тұрақты қысымдағы және тұрақты көлемдегі молярлық жылу сыйымдылықтардың қатынасын білу маңызды:
Бақылау сұрақтары: 1. Молекулалардың жылдамдық бойынша, энергия бойынша таралу функциясының физикалық мәні қандай? 2. Молекулалардың еркін жүру жолының орташа ұзындығы газ температурасына тәуелді ме? 3. Идеал газдың ішкі энергиясы деген не? Жүйенің ішкі энергиясы қандай процестің салдарынан өтеді? 4. Газдың жылу сыйымдылығы деген не? Жылу сыйымдылығының 5. Еріктілік дәрежесі қалай анықталады? 6. Идеал газдың ішкі энергиясы деген не? Жүйенің ішкі энергиясы қандай процестің салдарынан өтеді? 7. Газдың жылу сиымдылығы деген не? Жылу сиымдылығының Әдебиеттер: НӘ3,6 №10 дәріс
Поиск по сайту: |
 кинетикалық энергияның
кинетикалық энергияның 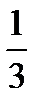 бөлігіне тең энергия келеді:
бөлігіне тең энергия келеді: . (9.14)
. (9.14) -ге тең кинетикалық энергия, ал тербелмелі қозғалыстың еркіндік дәрежесіне орта есеппен
-ге тең кинетикалық энергия, ал тербелмелі қозғалыстың еркіндік дәрежесіне орта есеппен  -ға тең кинетикалық энергия келеді. Тербелмелі қозғалыстың еркіндік дәрежесіне екі есе көп энергия келу себебі, кинетикалық энергияға тең потенциялық энергия да ескеріледі. Молекуланың еркіндік дәрежелерін ескере отырып, орташа кинетикалық энергияның өрнегін жазуға болады:
-ға тең кинетикалық энергия келеді. Тербелмелі қозғалыстың еркіндік дәрежесіне екі есе көп энергия келу себебі, кинетикалық энергияға тең потенциялық энергия да ескеріледі. Молекуланың еркіндік дәрежелерін ескере отырып, орташа кинетикалық энергияның өрнегін жазуға болады: . (9.15)
. (9.15) .
. молекулалардың кинетикалық энергияларының қосындысына тең:
молекулалардың кинетикалық энергияларының қосындысына тең: , (9.16)
, (9.16) (9.17)
(9.17) - газдың молярлық массасы,
- газдың молярлық массасы,  - зат мөлшері.
- зат мөлшері. .
. ;
;  - зат мөлшері
- зат мөлшері , мұндағы
, мұндағы  - молярлық масса.
- молярлық масса. .
.
 . Демек, тұрақты көлемдегі молярлық жылусыйымдылық 1 моль газды 1 К температураға дейін қыздырғандағы ішкі энергияның өзгерісіне тең.
. Демек, тұрақты көлемдегі молярлық жылусыйымдылық 1 моль газды 1 К температураға дейін қыздырғандағы ішкі энергияның өзгерісіне тең. екенін ескере отырып, тұрақты көлемдегі жылусыйымдылықтың өрнегін жазайық:
екенін ескере отырып, тұрақты көлемдегі жылусыйымдылықтың өрнегін жазайық: 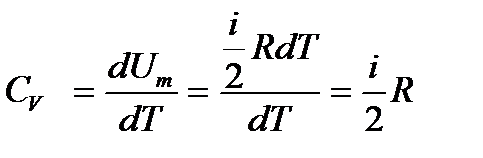
 .
.


 немесе
немесе  - өрнегі Майер теңдеуі деп аталады.
- өрнегі Майер теңдеуі деп аталады.

 мен
мен  қайсысы көп және неге?
қайсысы көп және неге?