 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Уравнение Нернста. Стандартный и равновесный потенциалы. Влияние рН на окислительно-восстановительный потенциал
Количественной характеристикой окислительно-восстановительной способности редокс-пары являются значения стандартного и реального окислительно-восстановительного потенциала. Реальный окислительно-восстановительный потенциал рассчитывается по уравнению Нернста. Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар. Вывод уравнения Нернста: Если в формулу Нернста подставить числовые значения констант СТАНДАРТНЫЙ ПОТЕНЦИАЛ (нормальный потенциал), значение электродного потенциала, измеренное в стандартных условиях относительно выбранного электрода сравнения (стандартного электрода). Обычно стандартные потенциалы находят в условиях, когда термодинамич. активности а всех компонентов потенциалопределяющей р-ции, протекающей на исследуемом электроде, равны 1.Стандартный электродный потенциал EО может быть рассчитан по уравнению:EО = –ΔGО/nF. Равновесный электродный потенциал – это потенциал электрода, когда на границе электрод – электролит протекает одна обратимая электрохимическая равновесная реакция. При равновесии скорости прямой (анодной) и обратной (катодной) реакций равны, устанавливается равенство электрохимических потенциалов всех частиц в обеих фазах, наблюдается материальный баланс по числу зарядов и частиц, участвующих в этих реакциях.В некоторых случаях надо знать не только направление окислительно-восстановительной реакции, но и насколько полно она протекает. Так, например, в количественном анализе можно опираться только на те реакции, которые практически протекают на 100% (или приближаются к этому).Степень протекания реакции слева направо определяется константой равновесия. Для реакции Рассмотрим окислительно-восстановительную пару:Fe3+ + e– = Fe2+.Уравнение Нернста в данном случае имеет вид: Будучи довольно сильной кислотой
При увеличении рН раствора, то есть при уменьшении концентрации ионов водорода равновесие (2) смещается в сторону прямой реакции, что влечет за собой снижение концентрации ионов Fe3+ в результате их превращения в гидроксокатионы FeOH2+. Это, в свою очередь, влияет на величину окислительно-восстановительного потенциала: дробь под знаком логарифма в выражении (1) уменьшается и, следовательно, уменьшается потенциал рассматриваемой окислительно-восстановительной пары. Иными словами, окислительные свойства катиона Fe3+ с увеличением рН раствора ослабевают, а восстановительные свойства Fe2+ усиливаются.
Поиск по сайту: |
 ,где
,где  — электродный потенциал,
— электродный потенциал,  — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;  — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);  — абсолютная температура;
— абсолютная температура;  — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1;  — число моль электронов, участвующих в процессе;
— число моль электронов, участвующих в процессе;  и
и  — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции. и
и  получим
получим 
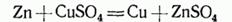 или
или  согласно закону действия масс, можно записать:
согласно закону действия масс, можно записать:  где К — константа равновесия.
где К — константа равновесия. (1)
(1) , гидратированный ион Fe3+×aq в значительной степени подвергается протолизу:Fe3+ + H2O = FeOH2+ + H+ (2).Напишем выражение константы кислотности для данной кислотно-основной пары:
, гидратированный ион Fe3+×aq в значительной степени подвергается протолизу:Fe3+ + H2O = FeOH2+ + H+ (2).Напишем выражение константы кислотности для данной кислотно-основной пары:  ,откуда
,откуда (3)
(3)