 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Структурная блок-схема ⇐ ПредыдущаяСтр 5 из 5
011 03
10 302 S SO3+ SO2+O2+N2
1 - (серная печь) сжигание серы S + O2 = SO2
2 – (контактный аппарат) контактное окисление 2SO2+ O2 = 2SO3
3 – (абсорбер) абсорбция SO3 SO3 + H2O = H2SO4
Составление системы уравнений материального баланса.
1.По 1-му блоку: по сере
2.По 2-му блоку
3. 4. 5.По 3-му блоку
6. 7. Исходные данные для расчета
Перепишу систему уравнений с учетом данных и обозначив неизвестные за Хi:
Х1 ∙ 0,95 / 32 = Х2 ∙ 0,09 Х3 = Х2 ∙ 0,09 ∙ 0,997 Х4 = Х2 ∙ (1-0,997) ∙ 0,09 Х5 = Х2 ∙ (0,21 – 0,09) – 0,5 ∙ Х2 ∙ 0,09 ∙ 0,997 98 ∙ 0,999 ∙ Х3 = 5000 ∙ 0,928 Х6 = Х3 ∙ 0,999 ∙ 18 + 5000 ∙ (1 – 0,928) Х7 = Х3 ∙ 80 ∙ (1 – 0,999) + Х4 ∙ 64 + Х5 ∙ 32 + 0,79 ∙ Х2 ∙ 28
Решение системы уравнений:
Х3 = 5000 ∙ 0,928 / 98 ∙ 0,999 = 47,4 Х2 = 47,4 / 0,09 ∙ 0,997 = 528,3 Х1 = 528,3 ∙ 0,09 ∙ 32 / 0,95 = 1601,6 Х4 = 528,3 ∙ (1-0,997) ∙ 0,09 = 0,14 Х5 = 528,3 ∙ (0,21 – 0,09) – 0,5 ∙ 528,3 ∙ 0,09 ∙ 0,997 = 39,7 Х6 = 47,4 ∙ 0,999 ∙ 18 + 5000 ∙ (1 – 0,928) = 1212,3 Х7 = 47,4 ∙ 80 ∙ (1 – 0,999) + 0,14 ∙ 64 + 39,7 ∙ 32 + 0,79 ∙ 528,3 ∙ 28 = 12969,1
Соответствие переменных потока
O2 G011 = N12 ∙ 0,21 ∙ 32 = 528,3 ∙ 0,21 ∙ 32 = 3552,2 кг N2 G011 = N12 ∙ 0,79 ∙ 28 = 528,3 ∙ 0,79 ∙ 28 = 11686 кг S S G10 = G011 ∙ (1- KS) = 1601,6 ∙ (1 – 0,95) = 80,1 кг H2SO4 GH2SO4 = G301 ∙ 0,928 = 5000 ∙ 0,928 = 4640 кг H2SO4 GH2O = G301 ∙ 0,072 = 5000 ∙ 0,072 = 360 кг O2 O2 G302 = N23 ∙ 32 = 39,7 ∙ 32 = 1270,4 кг SO2 SO2 G302 = N23 ∙ 64 = 0,14 ∙ 64 = 8,96 кг SO3 SO3 G302 = N23 ∙ (1- KSO3) ∙ 80 = 47,4 ∙ (1 – 0,999) ∙ 80 = 3,792 кг
Материальный баланс ХТС
Поточная диаграмма
Вода

          Сера Серная кислота Сера Серная кислота
Сера Выхлоп. газы
Расчет основных технологических показателей процесса
1. Расходные коэффициенты по сырью
а) теоретический
МS 32 γстех = ——— = ——— = 0,33 МН2SO4 98
б) практический
GS 1601,6 γ = ——— = ——— = 0,35 GН2SO4 4640
Теоретический расходный коэффициент характеризует минимальный расход сырья на единицу массы продукта. Практический расходный коэффициент больше теоретического из-за неполноты использования сырья, так как выхлопные газы содержат некоторое количество SO2 и SO3.
2. Конверсия
NН2SO4 47,35 X = ——— = ——— = 0,95 N S 50,05
3. Селективность процесса
NН2SO4 47,35 φ = ———— = —————— = 0,996 N 0S - N S (50,05 – 2,50)
4. Выход
η = X ∙ φ = 0,95 ∙ 0,996 = 0,95
Заключение Важнейшие тенденции развития производства серной кислоты:
1. Увеличение мощности аппаратуры при одновременной комплексной автоматизации производства. 2. Интенсификация процессов путем применения реактора кипящего слоя (печи и контактные аппараты КС) и активных катализаторов, также производства и переработки концентрированного диоксида с использованием кислорода. 3. Разработка энерготехнологических систем с максимальным использованием теплоты экзотермических реакций, в том числе циклических и систем под давлением. 4. Увеличение степеней превращения на всех стадиях производства для снижения расходных коэффициентов по сырью и уменьшению вредных выбросов. 5. Использование сернистых соединений (S, SO2, SO3, H2O) из технологических и отходящих газов, а также жидких отходов других производств. 6. Обезвреживание отходящих газов и сточных вод. - существующие в настоящее время технологические установки для производства серной кислоты загрязняют биосферу диоксидом и триоксидом серы; промывные воды очистного отделения содержат такие токсичные вещества, как соединения мышьяка.
Список используемой литературы
1. «Общая химическая технология». Учеб. для техн. Вузов / А.М. Кутепов, Т.И. Бондарева, М.Г. Беренгартен. – 2-е изд.., испр. и доп. – М.: высш. шк.., 1990. – 520 с.
2. «Основы химической технологии»: учеб. для студентов хим. - технол. спец. вузов/ И.П. Мухленов, А.Е. Горштейн, Е.С. Тумаркина, под ред. И.П. Мухленова. – 4-е изд.., перераб. и доп. – М.: высш. шк.., 1991. – 463 с.
3. «Технология серной кислоты». А.Г. Амелин – 2-е изд.., перераб., М: Химия, 1983
4. «Расчёт материального баланса химико-технологических систем интегральным методом». Г.Н. Кононова, В.В. Сафонов, Е.В. Егорова. Москва, 1999 год
[Д1]
Поиск по сайту: |





 O2+N2 H2O
O2+N2 H2O
 1 2 3
1 2 3




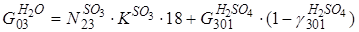















 Воздух
Воздух