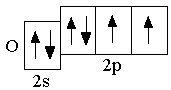|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Элементы первого периода (H, He)
s-орбитали первого энергетического уровня находится 1 электрон.
В атоме гелия (Z = +2) два электрона, которые находятся также на 1s орбитали. Электронно-графическая схема атома гелия:
Электронная формула атома гелия – 1s2 (на s-орбитали первого энергетического уровня находятся 2 электрона). Элементы второго периода (Li–Ne)
У следующего за гелием элемента лития (Z = +3) третий электрон уже не может разместиться на первом энергетическом уровне, т.к. как на одной орбитали не может находиться более двух электронов. Поэтому третий электрон должен располагаться на втором энергетическом уровне n = 2.
Электронную конфигурацию атома следующего за литием элемента бериллия (Z = +4) отражает сокращённая электронная формула 2s2. Сокращённая электронно графическая схема атома Be:
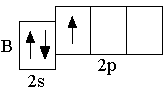
B 2s22p1 C 2s22p2 N 2s22p3
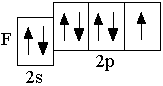
O 2s22p4 F 2s22p5 Ne 2s22p6
При записи сокращённых электронных формул важно понимать, что число электронов на внешнем энергетическом уровне атомов s- и p-элементов равно номеру группы.
Поиск по сайту: |
 В атоме водорода (Z = +1) единственный электрон находится на самом низком из возможных энергетических уровней: n = 1, который образован одной s-орбиталью. Электронно-графическая схема атома водорода:
В атоме водорода (Z = +1) единственный электрон находится на самом низком из возможных энергетических уровней: n = 1, который образован одной s-орбиталью. Электронно-графическая схема атома водорода: Электронная формула атома водорода 1s1 показывает, что на
Электронная формула атома водорода 1s1 показывает, что на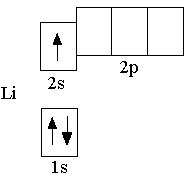
 Сначала заполняется более низкая по энергии орбиталь. Поэтому третий электрон в атоме лития располагается на
Сначала заполняется более низкая по энергии орбиталь. Поэтому третий электрон в атоме лития располагается на  Элементы, в атомах которых электронами заполняются s-орбитали, называются s-элементами (т.е. H, He, Li, Be – это s-элементы)
Элементы, в атомах которых электронами заполняются s-орбитали, называются s-элементами (т.е. H, He, Li, Be – это s-элементы)  . Следующие за бериллием элементы второго периода – бор, углерод, азот, кислород, фтор, неон – являются p-элементами: у них происходит заполнение электронами
. Следующие за бериллием элементы второго периода – бор, углерод, азот, кислород, фтор, неон – являются p-элементами: у них происходит заполнение электронами