|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Органічні кислоти аліфатичного рядуСтр 1 из 5Следующая ⇒
Лекція № 4. Речовини вторинного походження 1. Органічні кислоти аліфатичного ряду. 1.1. Леткі кислоти. 1.2. Нелеткі кислоти. 1.3. Роль органічних кислот у рослині. 2. Фенольні сполуки. 2.1. С6-Феноли. 2.2. С6-С1-Фенольні кислоти. 2.3. С6-С3-Гідроксикоричні кислоти і кумарини. 2.4. С6-С3-С6-Флавоноїди. 2.5. Олігомерні фенольні сполуки. 2.6. Полімерні фенольні сполуки. 2.7. Утворення фенольних сполук. 2.8. Функції фенолів у рослині. 3. Глікозиди. 3.1. О-Глікозиди. 3.2. S-Глікозиди. 3.3. N-Глікозиди. 3.4. С-Глікозиди. 3.5. Роль глікозидів у рослинах. 4. Терпени і терпеноїди. 4.1. С5-Ізопрен. 4.2. С10-, С15-Терпени і терпеноїди – компоненти ефірних олій. 4.3. Ефірні олії. 4.4. Роль ефірних олій у рослині. 4.5. Одержання ефірних олій. 4.6. Використання ефірних олій. 4.7. С20-, С25-, С30-Терпени і терпеноїди – компоненти смол. 4.8. Політерпени. 4.9. Біосинтез терпенів і терпеноїдів. 4.10 Функції терпенів і терпеноїдів у рослині. 5. Алкалоїди. 5.1. Справжні алкалоїди. 5.2. Протоалкалоїди. 5.3. Псевдоалкалоїди (терпеноїдні алкалоїди). 5.4. Біосинтез алкалоїдів. 5.5. Функції алкалоїдів у рослині.
Рослини здатні синтезувати велику кількість різноманітних речовин. Це в основному речовини рослинного походження, що у тварин, як правило, не зустрічаються. Їх називають речовинами вторинного походження, або вторинного обміну. Ці речовини не мають власних шляхів синтезу і тому утворюються в основних метаболічних процесах рослин. Їхній біосинтез відбувається на відгалуженнях шляхів синтезу білків, вуглеводів, ліпідів. Учені вважають, що в рослинах на відгалуженнях і закінченнях таких шляхів функціонує широкий спектр ферментів, що дозволяє їм синтезувати велику різноманітність речовин. Серед речовин вторинного походження є дуже важливі фізіологічно активні сполуки (глікозиди, терпени, терпеноїди тощо); інші речовини можуть накопичуватися в клітині у великій кількості, що є відмінною рисою її метаболізму (фенольні сполуки, ефірні олії тощо). Речовини вторинного походження поділяють на декілька груп: 1.Органічні кислоти аліфатичного ряду. 2.Фенольні сполуки. 3.Глікозиди. 4.Терпени і терпеноїди. 5.Алкалоїди. Органічні кислоти аліфатичного ряду Органічні кислоти аліфатичного ряду в малих кількостях присутні в цитоплазмі і можуть накопичуватися в клітинному соку у вільному стані у вигляді солей та складних ефірів. Органічні кислоти поділяють на дві групи: леткі та нелеткі. Леткі кислоти Леткі кислоти переганяються з парою та мають запах. До них належать мурашина, оцтова, пропіонова, масляна і валеріанова кислоти. Мурашина кислота знайдена в малині, яблуках, насінні квасолі, кропиві, хвої. У рослинах вона утворюється при декарбоксилюванні щавлевої кислоти. Мурашина кислота бере участі, в утворенні пуринових нуклеотидів і, можливо, в утворенні хлорофілу в.
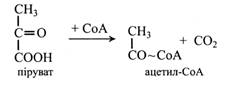
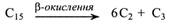
Оцтова кислота поширена в плодах та насінні. Її багато, наприклад, у яблуках, а в зерні пшениці та кукурудзи вона складає до 85 % від загального вмісту органічних кислот. Оцтова кислота застосовується в харчовій промисловості. У вигляді ацетил-СоА оцтова кислота утворюється при декарбоксилюванні піровиноградної кислоти під дією піруватдегідрогенази, а також при β-окисленні жирних кислот і деяких амінокислот (валін, лейцин). Ацетил-СоА може розщеплювати ся до СО2 і Н2О в ЦТК, може надходити у гліоксилатний цикл і брати участь у глюконеогенезі (у перетворенні жирів на вуглеводи). Із ацетил-СоА синтезуються також каротиноїди, стероїди, ефірні олії, смоли. При відщепленні СоА утворюється вільна кислота.
Пропіонова кислота виявляється в рослинах у малих кількостях і звичайно утворюється при β-окисленні жирних кислот з непарним числом вуглецевих атомів.
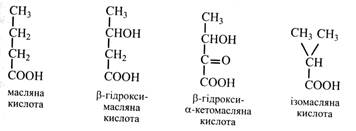
Масляна кислота зустрічається в рослинах рідко й у малих кількостях. Частіше знаходять її похідні: β-гідроксимасляна, β-гідрокси-α-кетомасляна та її ізомер – ізомасляна тощо.
Валеріанова кислота та її ізомер – ізовалеріанова є в деяких рослинах (валеріана, гваюла).
Леткі органічні кислоти у вигляді складних ефірів містяться в плодах. Ефіри мають запах і надають його плодам.
Нелеткі кислоти За кількістю карбоксильних груп ці кислоти поділяють на моно-, ди- і трикарбонові. Монокарбонові кислоти У цій групі будуть розглянуті такі кислоти: глюконова, гліколева, гліоксилева, піровиноградна, молочна.
Одержують глюконову кислоту з культурального середовища деяких пліснявих грибів, де вона накопичується в досить великій кількості. Глюконова кислота та її солі, особливо кальцієва, використовуються в медицині як детоксиканти й антиалергійні засоби. Гліколева кислота зустрічається в рослинах у невеликій кількості та відіграє важливу роль у процесі фотодихання. Гліоксилева кислота також міститься в рослинах у невеликих кількостях, але бере участь у важливих метаболічних процесах: у фотодиханні та гліоксилатному циклі. З гліоксилевої кислоти при переамінуванні утворюється гліцин.
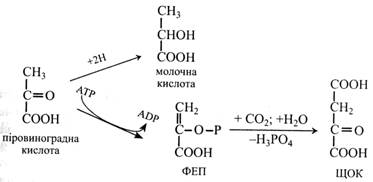
Піровиноградна кислота є в багатьох рослинах, але вона не накопичується, оскільки бере участь у різних процесах обміну. Ця кислота утворюється при дисиміляції вуглеводів у гліколізі та зв'язує обмін вуглеводів з обміном білка і ліпідів. Із пірувату утворюються амінокислота аланін і ацетил-СоА. Крім того, вона є джерелом молочної та щавлевооцтової кислот. Молочна кислота утворюється при відновленні піровиноградної кислоти під дією лактатдегідрогенази, а ЩОК – після фосфорилювання її до ФЕП та карбоксилювання останнього.
Молочна кислота виявлена в багатьох рослинах, але більше її міститься в листках малини. Часто накопичується у рослинах в анаеробних умовах. Багато молочної кислоти утворюється при молочнокислому бродінні в молочнокислих продуктах, у тісті, при бродінні овочів. Утворюється вона при відновленні пірувату. Застосовується молочна кислота в текстильній та шкіряній промисловості при фарбуванні тканин і шкіри як протрава, у медицині як носій мікроелементів, у харчовій промисловості при виготовленні цукерок, безалкогольних напоїв тощо. Дикарбонові кислоти До дикарбонових органічних кислот відносять щавлеву, малонову, бурштинову, фумарову, щавлевооцтову, яблучну, винну кислоти.
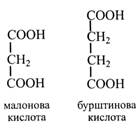
Малонову кислоту знайдено в листках злаків, бобових, у плодах лимона, квітках жоржин. Пов'язана з СоА малонова кислота бере участь у синтезі жирних кислот.
Бурштинова кислота виявлена в плодах червоної смородини, черешні, аґрусу, винограду, в яблуках, у незрілих вишнях. У ЦТК вона послідовно перетворюється у фумарову, щавлевооцтову і яблучну кислоти. Крім того, вона – продукт гліоксилатного циклу. Фумарова кислота в невеликій кількості присутня в деяких рослинах (мак, ряст), а також у лишайниках і грибах. Приєдную чи аміак, фумарова кислота утворює аспарагінову кислоту. Про її зв'язки з іншими дикарбоновими кислотами йшлося раніше. Щавлевооцтова кислота дуже активна в метаболізмі рослин і тому не накопичується. Вона бере участь у реакціях ЦТК, гліоксилатного циклу, у фотосинтезі С4- і САМ-рослин, при переамінуванні утворює аспарагінову кислоту.
Яблучна кислота дуже поширена в рослинах, особливо в плодах кісточкових культур – горобини, барбарису, кизилу, у яблуках, а також у помідорах. Особливо багато яблучної кислоти в плодах барбарису (до 6 %), у листках тютюну і махорки (до 6,5%), у м'ясистих органах сукулентів (до 8-10 %). Відсутня вона в плодах цитрусових і журавлині. Утворюється яблучна кислота в ЦТК, гліоксилатному циклі з ЩОК і при фотосинтезі у С4- і САМ-рослин. Вона має приємний смак та властивість угамовувати спрагу і використовується при виготовленні безалкогольних напоїв і кондитерських виробів. Винну кислоту знаходять звичайно в рослинах південних широт. Її багато в плодах винограду. В інших рослинах її, навпаки, дуже мало або зовсім немає. При виготовленні й витримці виноградних вин утворюються відходи у вигляді осаду. Це винний камінь, що являє собою монокалієву сіль винної кислоти – кремортартрат. Винна кислота і винний камінь застосовуються при виготовленні фруктових вод, хімічних розпушувачів тіста, для протрави тканин при їх фарбуванні, у медицині. Калій-натрієва сіль винної кислоти (сегнетова сіль) використовується в радіотехнічній промисловості та при кількісному визначенні цукрів. Участь винної кислоти у метаболізмі рослин поки що не вивчена.
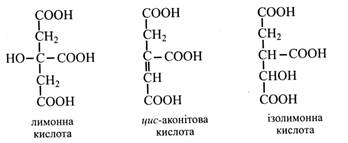
Трикарбонові кислоти До них відносять лимонну, ізолимонну і цис-аконітову кислоти. Ці кислоти взаємоперетворюються в ЦТК і в гліоксилатному циклі.
Лимонна кислота поширена в рослинах. У плодах смородини, малини, суниці лимонна кислота переважає над яблучною. Особливо багато лимонної кислоти у плодах цитрусових (до 9 %), у листках махорки (до 7-8 %). У промислових масштабах лимонну кислоту одержують з культуральної рідини плісневого гриба Aspergillus niger. Лимонна кислота застосовується в харчовій промисловості, а її натрієва сіль у якості консерванту крові. Цис-аконітова кислота вперше була отримана з листків аконіту. Зустрічається вона у невеликих кількостях у багатьох рослинах (листки злаків). Ізолимонна кислота в значних кількостях міститься у деяких рослинах. У сукулентів її вміст може сягати 18 %, а в плодах ожини вона складає 2/3 усіх органічних кислот. Роль органічних кислот у рослині 1.Органічні кислоти відіграють важливу роль в процесі фотосинтезу, особливо в С4- і CAM-рослин, а також у фотодиханні. 2.Багато органічних кислот беруть участь у процесі дихання рослин (гліколіз, ЦТК, ПФЦ). Так, ЦТК і гліоксилатний цикл цілком складаються з реакцій перетворення органічних кислої, а ФЕП є кінцевим продуктом гліколізу. 3.Велика роль органічних кислот в обміні ліпідів. З них синтезуються жирні кислоти, стероїди, каротиноїди. 4.Ряд органічних кислот є вихідними сполуками при утворенні амінокислот (ЩОК, фумарова, ПВ тощо). 5.Органічні кислоти зв'язують у рослинах обмін вуглеводів з обміном білків і ліпідів. 6.З органічних кислот синтезуються терпени та терпеноїди (ефірні олії, смоли, фітогормони – абсцизова кислота і гібереліни тощо). 7.Органічні кислоти обумовлюють низький рівень рН клітинного соку, а у «кислих» рослин ще й ємний механізм знешкодження аміаку. Фенольні сполуки Феноли – це сполуки, у молекулах яких міститься ароматичне (бензольне) кільце, пов'язане з однією або декількома групами –ОН. Великий вміст фенолів характерний для рослинної клітини. У тваринному організмі бензольні кільця не синтезуються, і можуть тільки перетворюватися, тому вони повинні постійно і підходити в організм з їжею. Однак багато фенольних сполук (убіхінон, адреналін, тироксин, серотонін та ін.) у тваринних тканинах виконують важливі функції. В наш час у рослинах знайдено декілька тисяч різноманітних фенольних сполук. Їх класифікують за будовою вуглецевого скелету. Розглянемо тільки найбільш важливі групи фенольних сполук: 1.С6-Феноли. 2.С6-С1-Фенольні кислоти. 3.С6-С3-Гідроксикоричні кислоти і кумарини. 4.С6-С3-С6-Флавоноїди. 5.Олігомерні фенольні сполуки. 6.Полімерні фенольні сполуки. С6-Феноли Сполуки, бензольне кільце яких пов'язано з декількома гідроксильними групами, називають поліфенолами.
Вільні феноли в рослинах є рідко і в малих кількостях. Так. фенол виявлений у голках і шишках сосни, в ефірній олії чорної смородини, пірокатехін – у лусках цибулі, листках бадану, гідрохінон – у корі і листках груші та бадану. Частіше зустрічаються похідні фенолів, в яких вони пов'язані з вуглецевим ланцюгом або циклом (наприклад, урушіол і тетрагідроканабінол).
Урушіол – це токсична речовина з листків сумаху. Тетрагідроканабінол є галюциногенною речовиною конопель.
До похідних бензохінону належать також пекуча речовина примули – примін і червоний пігмент мухомора – мускаруфін.
С6-С1-Фенольні кислоти У рослинах поширені фенольні кислоти. Найчастіше вони містяться в тканинах у зв'язаному стані та звільняються при виділенні з тканин і гідролізі.
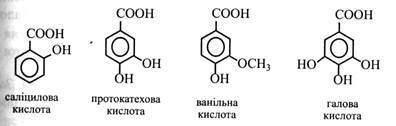
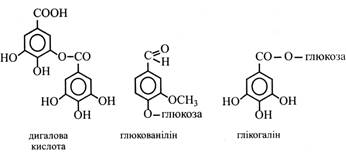
Саліцилова кислота міститься в коренях дуба і виділяється як алелопатичний агент у навколишнє середовище. Крім того, у наш час виявлена її регулююча дія на ряд фізіологічних і біохімічних процесів у рослині (утворення етилену, відновлення нітратів тощо). Протокатехова кислота знайдена в лусках цибулі. Ванільна і галова кислоти зустрічаються в деревині. Остання входить до складу деяких дубильних речовин і може утворювати димери – дигалову кислоту, у молекулі якої складноефірним зв'язком з'єднані два залишки галової кислоти.
У рослинах було виявлено похідні фенольних кислот – альдегіди і спирти. Наприклад, у корі верби присутній саліциловий спирт. Але особливо відомий ванілін – ванільний альдегід. Він має дуже приємний запах і у вигляді глікозиду – глюкованіліну міститься в плодах і гілках ванільного дерева. Глікозид і сам ванілін широко застосовуються в кондитерській, миловарній і парфумерній промисловості. Фенольні кислоти можуть з'єднуватися складноефірними зв'язками з цукрами, частіше з глюкозою. Із ряду рослин (ревінь, евкаліпт) виділений глікогалін, у якому карбоксильна група галової кислоти зв'язана з глікозидним гідроксилом глюкози. С6-С3-Гідроксикоричні кислоти і кумарини Широко поширені в рослинах гідрооксикоричні кислоти. Зазвичай вони перебувають у зв'язаному стані, а у вільному, крім кавової, зустрічаються рідко.
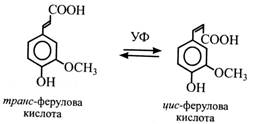
Для гідроксикоричних кислот характерна цис-транс-ізомерія. У розчині встановлюється рівновага між транс- і цис-формами. Ультрафіолет зрушує цю рівновагу вбік утворення цис-форм.
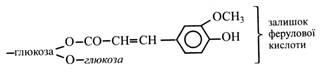
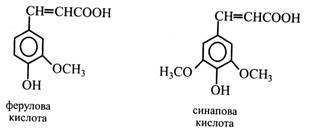
Цис-ізомери гідроксикоричних кислот є активаторами ростових процесів рослин, а транс-ізомери таких властивостей не мають. У рослинах зустрічаються гідроксикоричні спирти – похідні відповідних кислот: кумарової – кумаровий спирт, ферулової – коніфериловий, синапової – синаповий. Спирти звичайно не накопичуються, а, очевидно, використовуються при утворенні лігніну, мономерами якого вони є.
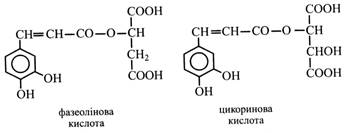
Гідроксикоричні кислоти можуть утворювати складні ефіри з органічними кислотами аліфатичного ряду. Так, кавова кислота утворює ефіри з яблучною та винною кислотами. Перший ефір називають фазеоліновою кислотою, що присутня у листках квасолі. Другий – цикориновою кислотою. Вона знайдена у листках цикорію.
У рослинах поширені ефіри гідроксикоричних кислот і цукрів, частіше глюкози. Так, у квітках петунії та ротиків виявлені ефіри кавової, кумарової, ферулової кислот, а в злаках узагалі більшість гідроксикоричних кислот міститься у формі ефірів. Крім того, гідроксикоричні кислоти входять до складу полісахаридів і білків. Наприклад, ферулова кислота знайдена у ксиланах пшеничної муки й у полісахаридах ананасів. Кумарини – це лактони, що утворюються при замиканні циклу між гідроксильною та карбоксильною групами в молекулі гідроксикоричної кислоти. При цьому бічний ланцюг кислоти має знаходитися в цис-формі, а гідроксил – в орто-положенні.
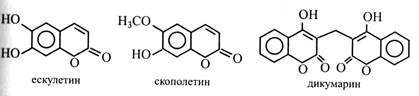
Кумарин – безбарвна кристалічна речовина з приємним запахом свіжоскошеного сіна. У вільному стані кумарин у рослинах не зустрічається. Він звичайно міститься у вигляді глікозидів (квітки і листки буркуну). У трав'янистих рослинах у клітинному соку є глікозид, який містить орто-кумарову кислоту. Під час косовиці рослинні тканини ушкоджуються, порушується проникність мембран. Глікозиди з клітинного соку стикаються з ферментами цитоплазми. Від глікозидів відщепляются цукри, і кумарова кислота після транс-цис-ізомеризації утворює лактон-кумарин. При цьому трава, що в'яне, набуває запаху сіна. Кумарин і його глікозиди використовуються в парфумерній промисловості та при виготовленні деяких сортів тютюну. У рослинах часто зустрічаються гідроксильовані кумарини в складі глікозидів. Наприклад, ескулетин з оплодня кінського каштана і скополетин із коренів скополії японської. Обидва ці кумарини мають Р-вітамінну активність та використовуються в медицині як засоби, що укріплюють стінки капілярів.
У буркуні білому знайдено дикумарин, який перешкоджає зсіданню крові. Цей та інші дикумарини використовуються як лікарські препарати, що запобігають утворенню тромбів. С6-С3-С6-Флавоноїди Це одна з найбільш різноманітних і поширених груп фенольних сполук. В основі будови молекул флавоноїдів лежить структура флавану, що складається з двох бензольних кілець і одного гетероциклічного (піранового).
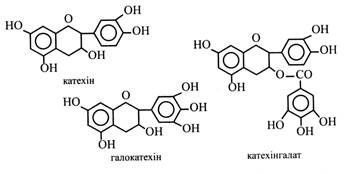
1) за ступенем окисленості або віднов-леності гетероциклічного кільця; 2) за природою і розташуванням замісників у кільцях А і Б (–ОН; –СН3; –ОСН3); 3) за здатністю утворювати глікозиди з різними цукрами. Флавоноїди поділяють на декілька груп. Ми будемо вивчати три основні групи: 1.Катехіни. 2.Антоціани. 3.Халкони. Катехіни – найбільш відновлені флавоноїди. Вони не утворюють глікозидів. Катехін уперше був виділений із деревини Acacia catechu, звідси його назва. Катехіни знайдені у понад 200 видів рослин. Серед них найвідомішими є катехін і галокатехін.
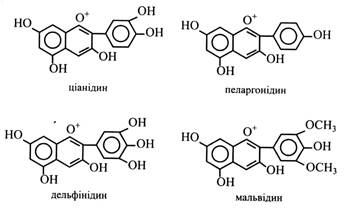
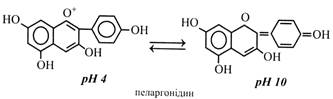
Катехіни можуть утворювати ефіри з галовою кислотою – катехінгалати і галокатехінгалати. Катехіни містяться в багатьох плодах (яблука, груші, айва, вишні, сливи, абрикоси, суниці, ожина, смородина, брусниця, виноград), у бобах какао, зернах кави, у корі і деревині багатьох дерев (верба, дуб, сосна, ялиця, кедр, кіпарис, акація, евкаліпт). Особливо багато катехінів у листках і молодих пагонах чаю (до 30 %). Окисні перетворення катехінів відіграють важливу роль у чайному виробництві. Продукти окислення, а це в основному димери катехінів, мають приємний слабов'яжучий смак і золотаво-коричневе забарвлення. Це визначає колір і смакові якості кінцевого продукту. Катехіни мають високу Р-вітамінну активність, зміцнюють капіляри та нормалізують проникність стінок судин. Аналогічно діють і димери катехінів у чаї. Катехіни як мономери входять до складу конденсованих дубильних речовин. Антоціани – найважливіші пігменти рослин. Вони забарвлюють пелюстки квіток, плоди, іноді листки в блакитний, синій, рожевий, червоний, фіолетовий кольори з різними відтінками і переходами. Всі антоціани – глікозиди. Їхніми агліконами є антоціанідини. Антоціани розчиняються у воді і містяться в клітинному соку. Особливістю будови антоціанідинів є наявність у гетероциклічному кільці чотиривалентного кисню (оксонію) і вільної позитивної валентності. У наш час відомо понад 20 антоціанідинів, серед яких найбільш поширені чотири: пеларгонідин, ціанідин, дельфінідин і мальвідин (метильоване похідне дельфінідину).
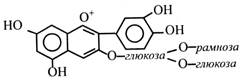
Антоціанідини частіше глікозильовані біля С-3, рідше в інших положеннях. Якщо глікозиди утворюються приєднанням двох цукрів, то це відбувається біля С-3 і С-5. Наприклад, глікозид пеларгонін, що містить дві молекули глюкози в С-3 і С-5 положеннях, виявлений у пеларгонії й айстр.
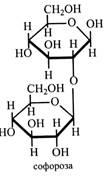
Як моносахариди в антоціанах зустрічаються глюкоза, галактоза, рамноза, ксилоза, рідше арабіноза, а в якості дисахаридів – найчастіше рутиноза, софороза, самбубіоза. Іноді антоціани містять трисахариди, звичайно розгалужені. Наприклад, у ягодах смородини і малини знайдений антоціан, у якому з цианідином зв'язаний розгалужений трисахарид.
Іноді до одного з цукрів антоціану ефірним зв'язком приєднується залишок гідроксикоричної кислоти.
Забарвлення антоціанів залежить від ряду чинників: 1) концентрації антоціанів у клітинному соку; 2) наявності у циклі Б груп –ОН і –ОСН3; 3) рН клітинного соку; 4) комплексоутворення антоціанів із катіонами; 5) копігментації – суміші антоціанів і присутності в клітинному соку інших речовин фенольної природи; 6) поєднання із забарвленням пластидних пігментів. Розглянемо ці чинники докладніше. 1. Концентрація антоціанів у клітинному соку може змінюватися в широкому діапазоні – від 0,01 до 15 %. Наприклад, у звичайній синій волошці міститься 0,05 % антоціану ціаніну, а в темно-пурпуровій його 13-14 %. 2. Збільшення кількості груп -ОН у молекулі антоціану підсилює інтенсивність синього забарвлення, а груп -ОСН3 – червоного. 3. У зв'язку з тим, що в молекулах антоціану є вільна валентність, забарвлення може змінюватися залежно від рівня рН. Звичайно у кислому середовищі антоціани мають червоний колір різної інтенсивності і відтінків, а в лужному – синій.
Такі зміни в забарвленні антоціанів можна спостерігати, додаючи кислоту або луг до кольорового соку смородини, вишні, столового буряка або червонокачанної капусти. У природі різких змін рН клітинного соку не відбувається, тому цей чинник не відіграє великої ролі у забарвленні антоціанів. Можна тільки зауважити, що деякі рожеві і червоні квітки при в'яненні синіють. Це вказує на зміну рН у клітинах, що відмирають. 4. Велике значення в забарвленні квіток і плодів має здатність антоціанів до хелатоутворення з іонами металів. Це добре видно на прикладі волошки і троянди. В їхніх пелюстках міститься однаковий антоціан – ціанін. У пелюстках синьої волошки ціанін утворює комплекс з іонами Fе (4 молекули ціаніну зв'язані з одним атомом Fе). У пелюстках червоних троянд присутній вільний ціанін. Інший приклад. Якщо звичайну гортензію з рожевими квітками вирощувати на мінеральному середовищі, що містить алюміній і молібден, то квітки набувають синього кольору. 5. Звичайно в клітинному соку багатьох квіток і плодів присутній не один, а декілька пігментів. При цьому забарвлення залежить від їх суміші, яку називають копігментацією. Так, забарвлення плодів чорниці обумовлене копігментацією дельфіні ну і мальвіну. У фіолетових квітках картоплі знайдено 10 різних антоціанів. Кольоровий малюнок пелюсток багатьох квіток визначається або локальним збільшенням концентрації одного пігменту (наперстянка), або накладенням додаткового пігменту на основний (у центрі квіток маку на загальному тлі пеларгоніну накладається висока концентрація ціаніну). На забарвлення впливає також копігментація антоціанів з іншими речовинами, наприклад із танінами. Так, пурпурові і темно-червоні троянди містять той самий ціанін, але в темно-черво них він копігментований з великою кількістю таніну. 6. При поєднанні синіх антоціанів клітинного соку і жовто-червоних каротиноїдів хромопластів утворюється коричневе забарвлення пелюсток деяких квіток. Деякі антоціани рослин
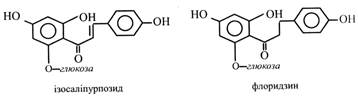
Халкони, або антохлори – це флавоноїди з розкритим гетероциклом. Вони надають пелюсткам квіток жовтого кольору. Їх поширення обмежене дев'ятьма родинами. Зустрічаються вони у вигляді глікозидів. Халконами, наприклад, є ізосаліпурпозид із жовтих квіток гвоздики, флоридзин із кори і листків яблуні. Флоридзин є інгібітором росту яблуні. При вживанні людиною він викликає одноразове інтенсивне виділення глюкози в кров – «флоридзиновий діабет».
Поиск по сайту: |

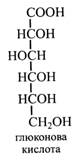 Глюконова кислота. Як зазначалося у лекції «Вуглеводи», глюконова кислота утворюється при окисленні глюкози і належить до групи альдонових кислот. У рослинах вона зустрічається в малих кількостях, бере участь у пентозофосфатному циклі, де з неї утворюються пентози.
Глюконова кислота. Як зазначалося у лекції «Вуглеводи», глюконова кислота утворюється при окисленні глюкози і належить до групи альдонових кислот. У рослинах вона зустрічається в малих кількостях, бере участь у пентозофосфатному циклі, де з неї утворюються пентози.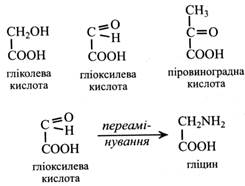
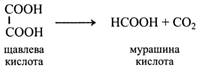
 Щавлева кислота дуже поширена в рослинах як у вільному стані, так і у вигляді солей. Особливо часто в клітинному соку рослин накопичується щавлевокислий кальцій. Він приймає форму кристалів та їхніх зростків (рафіди, друзи). Їх можна бачити в стеблах і листках сукулентів, бегонії, щавлю. Багато щавлевої кислоти виділяють у культуральну рідину плісняві гриби. Щавлева кислота утворюється з двох молекул мурашиної кислоти або при окисленні гліоксилевої кислоти.
Щавлева кислота дуже поширена в рослинах як у вільному стані, так і у вигляді солей. Особливо часто в клітинному соку рослин накопичується щавлевокислий кальцій. Він приймає форму кристалів та їхніх зростків (рафіди, друзи). Їх можна бачити в стеблах і листках сукулентів, бегонії, щавлю. Багато щавлевої кислоти виділяють у культуральну рідину плісняві гриби. Щавлева кислота утворюється з двох молекул мурашиної кислоти або при окисленні гліоксилевої кислоти.




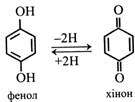 При окисленні фенолів утворюються хінони (бензохінони). У вільному стані вони в рослинах не виявляються, про те поширені їхні похідні. Наприклад, похідними бензохінонів є переносники електронів у ЕТЛ фотосинтезу і дихання – пластохінон та убіхінон.
При окисленні фенолів утворюються хінони (бензохінони). У вільному стані вони в рослинах не виявляються, про те поширені їхні похідні. Наприклад, похідними бензохінонів є переносники електронів у ЕТЛ фотосинтезу і дихання – пластохінон та убіхінон.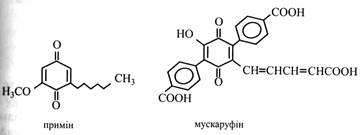



 Групи флавоноїдів розрізняються:
Групи флавоноїдів розрізняються: