 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Давление пара неидеальных растворов. Закон Генри ⇐ ПредыдущаяСтр 3 из 3
Для таких растворов: давление пара компонента не является прямо пропорциональным его концентрации, выраженной в мольных долях во всём диапазоне концентраций Давление рапа компонента пропорционально его мольной доле при низких концентрациях, но константа пропорциональности не равна давлению пара чистой жидкости. Обнаружены как отрицательные отклонения от закона Рауля. (Смесь ацетон-хлороформ)
так и положительные отклонения от закона Рауля (смесь ацетон - сероуглерод)
Объяснение отрицательному отклонению (взаимодействие ацетон-хлороформ): Образуются слабые водородные связи между кислородом ацетона и водородом хлороформа. Водородная связь - особый тип связи между двумя молекулами или двумя частями молекулы, когда протон оказался связанным с двумя атомами, один из которых обычно F, O, N. При положительном отклонении от закона Рауля молекулы, принадлежащие к разным типам, вытесняют друг друга, что приводит к несмешиваемости двух жидкостей. Если давление P пара компонента над разбавленным раствором приближается к P пара чистого компонента =>создаются благоприятные условия для разделения фаз (разделение фаз происходит в том случае, когда изобарный потенциал двухфазной системы ниже чем G гомогенной системы). Закон Генри Смеси ацетон-хлороформ и ацетон-сероуглерод не подчиняются закону Рауля. Из рисунков видно, что парциальное давление компонента, присутствующего в меньшей концентрации в случае растворов прямо пропорционально его мольной доле X2.
"2" - к растворённому веществу (т.е к компоненту с меньшей концентрацией) К2 - константа Генри. В случае неидеальных растворов закон Генри справедлив для растворённого вещества в том же интервале концентраций, в котором закон Рауля справедлив для растворителя. ОДЗ концентраций одна и та же для растворённого вещества в законе Генри и для растворителя в законе Рауля. В случае идеальных растворов
С помощью констант Генри выражают растворимость газа в жидкостях. Существуют таблицы K2. Закон Генри выполняется с точностью 1-3% для многих слаборастворимых газов до давления 1 атм.. Для описания неидеальных растворов хочется (удобно) пользоваться уравнениями той же формы, что и для идеальных растворов. Для этого вводят понятие активности ai и коэффициента активности fi с помощью следующих уравнений:
µi - химический потенциал компонента i. Активность - это число, единицы концентрации, если они вообще используются вводятся через определение стандартного состояния
Условие I Если раствор состоит из жидких компонентов, то можно считать, что коэффициент активности любого компонента
Если оба компонента подчиняются закону Рауля во всём диапазоне концентраций (как в идеальном растворе) то их коэффициент активности равен 1 при всех концентрациях. Условие II Это условие удобно использовать, если нельзя изменять мольные доли обоих компонентов вплоть до 1. Например, одним из компонентов может быть газ или твёрдое тело. Тогда для растворённого вещества и растворителя принимаются разные условия. Коэффициент активности растворителя определяется в соответствии с условием I.
Растворитель обычно компонент, присутствующий в большей концентрации. Коэффициент активности растворённого вещества
Следовательно,
Поиск по сайту: |
 закон Рауля.
закон Рауля.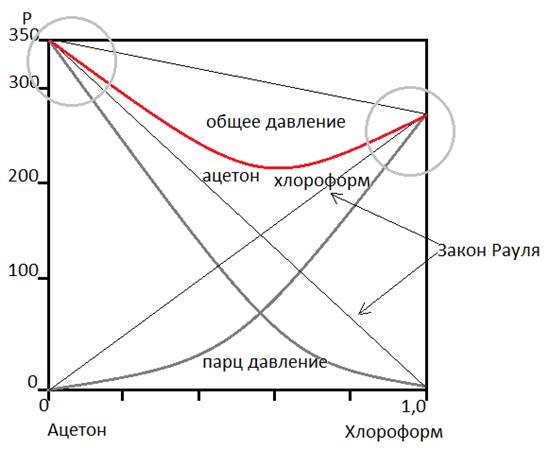


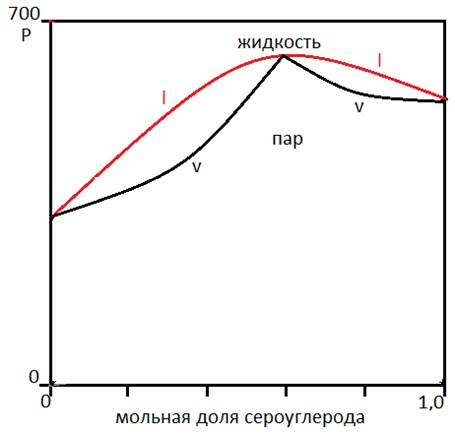

 закон Генри
закон Генри  закон Рауля.
закон Рауля. Можно найти значение K2 из графика зависимости
Можно найти значение K2 из графика зависимости 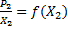 экстраполируя к X2=0.
экстраполируя к X2=0.
 в стандартном состоянии, когда ai=1 является функцие только Т и Р.
в стандартном состоянии, когда ai=1 является функцие только Т и Р.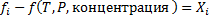
 для неэлектролитов, то есть для растворов, в которых растворённое вещество не диссоциирует. Для электролитов вводят более сложные соотношения.
для неэлектролитов, то есть для растворов, в которых растворённое вещество не диссоциирует. Для электролитов вводят более сложные соотношения.
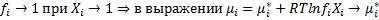 (химический потенциал в стандартном состоянии)=G 1 моля чистого компонента i при данных Т и Р.
(химический потенциал в стандартном состоянии)=G 1 моля чистого компонента i при данных Т и Р.
 по мере того как его мольная доля
по мере того как его мольная доля 
 .
. для растворённого вещества есть µi чистого растворённого вещества в гипотетическом стандартном состоянии. В этом состоянии растворённое вещество с Xi=1 имеет свойства, которые оно имело бы в бесконечно разбавленном растворе.
для растворённого вещества есть µi чистого растворённого вещества в гипотетическом стандартном состоянии. В этом состоянии растворённое вещество с Xi=1 имеет свойства, которые оно имело бы в бесконечно разбавленном растворе.