 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Электрические аккумуляторы
Аккумулятор является вторичным источником электрического тока, так как он может отдавать ток лишь после предварительного заряда, в отличие от гальванических элементов, которые дают ток без предварительного заряда и называются поэтому первичными элементами. Заряд аккумулятора состоит в том, что его подключают к источнику электрического тока. В результате процесса электролиза химическое состояние пластин аккумулятора меняется и между ними устанавливается определенная разность потенциалов. Аккумуляторы бывают двух типов – кислотные (свинцовые) и щелочные. Кислотная аккумуляторная батарея (АКБ) представляет собой эбонитовый сосуд с налитым туда водным раствором серной кислоты (H2SO4). Электродами аккумулятора служат свинцовые, специально подготовленные пластины (рис.4). Устройство обслуживаемой АКБ приведено на рис.5
Рис.4. Электроды аккумулятора.
Рис.5. Устройство обслуживаемой АКБ: 1 – корпус; 2 – отрицательный электрод (пластина); 3 – сепаратор; 4 – положительный электрод (пластина); 5 – баретка; 6 – опорные призмы; 7 – крышка; 8 – пробка заливного отверстия; 9 – положительный вывод; 10 – межэлементная перемычка (соединительный мостик); 11 – отрицательный вывод.
При заряде и разряде аккумулятора в нем происходит целый ряд сложных химических реакций. Если отвлечься от побочных реакций, то в упрощенном виде процессы разряда и заряда аккумулятора можно представить примерно следующим образом. В заряженном аккумуляторе (рис.6, а) в результате произошедших при разряде реакций положительная пластина будет состоять из перекиси свинца (PbO2), а отрицательная из губчатого свинца (Pb). Напряжение на выводах заряженного аккумулятора равно 2-2,1 В. Если замкнуть выводы аккумулятора на сопротивление (рис.6, б), то внутри аккумулятора ток пойдет от отрицательной пластины к положительной. Так как раствор серной кислоты (H2SO4) в воде (Н2О), как говорят диссоциирован, т.е. молекулы серной кислоты распались на положительные ионы водорода (Н2) и отрицательные ионы сернокислотного остатка (SO4), то при разряде аккумулятора ионы водорода направляются к положительной пластине, а ионы сернокислотного остатка – к отрицательной. Реакции, происходящие при этом будут таковы: на положительной пластине
на отрицательной пластине
Складывая почленно обе части этих уравнений, получаем одно уравнение реакции разряда аккумулятора
Следовательно, при разряде аккумулятора на обеих пластинах образуется сернокислый свинец
Рис.6. Кислотный аккумулятор. а – аккумулятор заряжен; б – разряд аккумулятора; в – состояние пластин аккумулятора после разряда; г – заряд аккумулятора.
При заряде свинцового аккумулятора напряжение, которое к нему подводится, изменяется от величины около 2 В в начале заряда до 2,5-2,7 В в конце заряда. Ток от внешнего источника (6, г) будет протекать внутри аккумулятора от положительной пластины к отрицательной. Положительные ионы водорода будут перемещаться к отрицательной пластине, а отрицательные ионы сернокислого остатка – к положительной пластине. При этом происходят следующие реакции: на положительной пластине
на отрицательной пластине
Складывая почленно обе части этих уравнений, получим
Таким образом, после заряда на положительной пластине образуется перекись свинца Во время заряда электрическая энергия постороннего источника тока превращается в химическую энергию, т.е. аккумулируется. Заряжать и разряжать аккумулятор только током, рекомендуемым заводом-изготовителем. Заряд и разряд током сверх нормы коробит и разрушает пластины. Щелочные аккумуляторы. Кроме кислотных аккумуляторов, нашли широкое применение также щелочные аккумуляторы. Пластинами в них являются железные решетки с различной активной массой. Массой положительной пластины (анода) является гидрат закиси никеля, а отрицательной пластины (катода) – гидраты закиси кадмия и железа. Электролитом является раствор едкого калия. Реакции, протекающие в щелочном аккумуляторе, могут быть представлены так: Анод: заряд гидрат закиси никеля -----→ гидрат окиси никеля ←----- разряд Катод: заряд гидрат закиси кадмия + гидрат закиси железа -----→ кадмий + железо ←----- разряд
Напряжение, которое нужно подать щелочному аккумулятору для заряда 1,8 В. Рабочее напряжение аккумулятора 1,25 В, разрядное напряжение 1 В. Сравнивая между собой кислотные и щелочные аккумуляторы, можно увидеть, что каждый из них обладает своими преимуществами и своими недостатками. К достоинствам щелочных аккумуляторов по сравнению с кислотными относятся: - прочность конструкции и нечувствительность к механическим сотрясениям; - малая чувствительность к колебаниям зарядного и разрядного токов и перегрузке; - меньшее количество вредных газов и испарений. К недостаткам щелочных аккумуляторов относятся: - меньшее рабочее напряжение по сравнению с кислотными аккумуляторами; - меньший КПД; - большее внутреннее сопротивление. Способность аккумулятора отдавать электрическую энергию характеризуется его емкостью. Емкостью кислотного или щелочного аккумулятора называется количество электричества, отданное им во время разряда.Емкость измеряется в ампер-часах и получается путем умножения разрядного тока, указанного заводом- изготовителем, на число часов разряда. Так, например, если на паспорте щелочного аккумулятора поставлена емкость 60 Ач и разрядный ток 7,5 А, аккумулятор можно разряжать в течение 60/7,5=8 час. И при этом напряжение его в 1,25 В уменьшится до 1В. Если этот же аккумулятор разряжать меньшим током (большим нельзя), например, в 4А, то аккумулятор можно использовать в течение 60/4=15 час.
Поиск по сайту: |


 ,
, .
. .
. (сульфат) (рис.6, в) и выделяется вода, т.е. уменьшается плотность электролита. Полный разряд свинцового аккумулятора недопустим и его можно доводить только до 1,8 В. Во время разряда химическая энергия аккумулятора переходит в электрическую энергию.
(сульфат) (рис.6, в) и выделяется вода, т.е. уменьшается плотность электролита. Полный разряд свинцового аккумулятора недопустим и его можно доводить только до 1,8 В. Во время разряда химическая энергия аккумулятора переходит в электрическую энергию. а
а
 б
б
 в
в
 г
г
 ,
, .
. .
. (коричневого цвета), а на отрицательной пластине – губчатый (пористый) свинец
(коричневого цвета), а на отрицательной пластине – губчатый (пористый) свинец 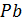 (светло-серого цвета), т.е. пластины аккумулятора возвращаются к своему первоначальному состоянию (
(светло-серого цвета), т.е. пластины аккумулятора возвращаются к своему первоначальному состоянию (