|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Изменения обмена веществ
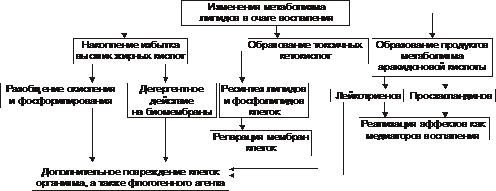
В очаге воспаления наблюдаются закономерные фазные изменения метаболизма. Их причины: действие флогогенного фактора и вторичные расстройства в ткани, выражающиеся в перестройке местных механизмов нервной и гуморальной регуляции, микроциркуляции, в формировании физико‑химических сдвигов. На начальном этапе воспаления в ткани (не только зоны первичной, но и вторичной альтерации) преобладают реакции катаболизма, затем — при развитии артериальной гиперемии и активации процессов пролиферации, — как правило, начинают доминировать анаболические реакции. Биологический «смысл» изменений метаболизма заключается в энергетическом и пластическом обеспечении местных адаптивных реакций в очаге воспаления, направленных на локализацию, уничтожение и элиминацию флогогенного агента, а также на ликвидацию патогенных последствий его воздействия. Углеводы В очаге воспаления метаболизм углеводов претерпевает характерные изменения, выражающиеся в преобладании гликолиза и развитии ацидоза. Причины • Повреждения мембранного аппарата и митохондриальных ферментов, возникающие под действием как флогогенного агента, так и других факторов, активирующихся или образующихся в ходе воспалительной реакции вторично. К этим последним относятся свободные радикалы и перекисные соединения, вещества с детергентным действием (ВЖК, гидроперекиси липидов), гидролазы лизосом, избыток Н+ и других агентов. • Избыток Ca2+, оказывающий (наряду с жирными кислотами) существенное разобщающее действие на окислительное фосфорилирование. • Увеличение в клетках уровня АДФ, АМФ и неорганического фосфата. Это активирует ключевые (лимитирующие) ферменты гликогенолиза и гликолиза. В связи с этим в очаге воспаления начинает возрастать удельный вес гликолитического ресинтеза АТФ. Проявления • увеличение поглощения тканью кислорода при одновременном снижении эффективности окисления глюкозы в процессе тканевого дыхания; • активация гликогенолиза и гликолиза; • уменьшение уровня АТФ в ткани; • накопление избытка лактата и пирувата. Последствия • Образующаяся при гликолизе АТФ, хотя и в недостаточной мере, но тем не менее может обеспечить поддержание энергозависимых процессов в клетках, особенно транспорта ионов и сокращения мышц, сохранение жизнеспособности и жизнедеятельности гистологических элементов в очаге воспаления. • Активация гликолиза сопровождается накоплением в клетках и во внеклеточной жидкости избытка промежуточных продуктов этого процесса, в том числе — пировиноградной, молочной и других кислот, что ведёт к формированию метаболического ацидоза. • На начальном этапе воспаления (когда многие митохондрии сохраняют свою структуру, а их ферменты — кинетическую активность) возобновление нормальной или близкой к ней оксигенации тканей сопровождается быстрым восстановлением эффективности тканевого дыхания, снижением интенсивности гликолиза и нормализацией энергетического обеспечения клеточных процессов. Липиды Обмен липидов в очаге воспаления характеризуется доминированием липолиза над реакциями их синтеза. Причины • Прямое повреждающее влияние флогогенного агента может привести к ферментативной и неферментативной деструкции мембранных фосфолипидов, ЛП, гликолипидов и других липидсодержащих соединений с высвобождением из них ВЖК, свободных липидов и образованием кетокислот. • Основной механизм липолиза в очаге воспаления — интенсификация гидролиза липидов и их комплексов с другими веществами в результате повышенного высвобождения липаз и фосфолипаз из повреждённых клеток, а также из лейкоцитов, в большом количестве накапливающихся в очаге воспаления. Помимо увеличения содержания липаз и фосфолипаз, в очаге воспаления отмечается значительное повышение их активности. Последнее связано с тем, что оптимум каталитической активности большинства липаз и фосфолипаз наблюдается в кислой среде. А в очаге воспаления, как известно, быстро развивается метаболический ацидоз. • Активация деструкции липидов за счёт интенсификации реакций свободнорадикального перекисного окисления липидов. В очаге воспаления усиление липопероксидных процессов связано со снижением активности антиоксидантных ферментов, увеличением содержания прооксидантных агентов (катехоламинов, гистамина, серотонина; ионов железа, высвобождающихся при разрушении миоглобина, Hb, кининов и других), а также повышением уровня субстратов перекисного окисления липидов, главным образом полиненасыщенных ВЖК: арахидоновой, линоленовой и других. Активация липопероксидации сопровождается образованием и накоплением избытка неметаболизируемых соединений (в частности гидроперекисей липидов), обладающих выраженным разрушающим эффектом в отношении органических соединений. Проявления • Активация процессов липолиза и накопление продуктов липолиза • Торможение реакций синтеза липидов • Активация перекисного окисления липидов и накопление перекисей и гидроперекисей липидов Последствия Последствия изменённого метаболизма липидов в очаге воспаления перечислены на рис. 5–4) и подробнее рассмотрены ниже.
Рис. 5–4. Изменения метаболизма липидов в очаге воспаления. • Активация лизосомальных, а также мембраносвязанных липаз и фосфолипаз приводит к отщеплению от липидов ВЖК и их накоплению. Последние оказывают в очаге воспаления существенный разобщающий эффект и снижают эффективность тканевого дыхания в митохондриях. • Детергентное (разрушающее) действие ВЖК на клеточные мембраны сопровождается образованием сквозных каналов в мембранах и нерегулируемым транспортом по ним ионов, молекул органических и неорганических соединений, как в клетку, так и из неё, что завершается, как правило, гибелью клетки. • Накопление избытка токсичных кетокислот (ацетоуксусной, • Повреждение вышеуказанными факторами не только клеток организма, но и самого флогогенного агента, если в его состав входят липиды. • Использование ВЖК для синтеза фосфолипидов мембран и ресинтеза цитоплазматических липидов. ВЖК при этом остаётся одним из основных энергоёмких субстратов биологического окисления. • В ходе метаболизма арахидоновой кислоты образуются Пг и лейкотриены, обладающие многими регуляторными эффектами. Белки Обмен белков характеризуется преобладанием протеолиза над процессами протеосинтеза. Главные причины • Прямое патогенное действие флогогенного агента, в том числе ферментативный протеолиз. • Массированное выделение из повреждённых паренхиматозных и стромальных клеток, а также из лейкоцитов протеолитических ферментов. Их активность значительна, так как каталитический оптимум большинства протеаз находится в кислом диапазоне рН (в очаге воспаления — метаболический ацидоз). • Активация свободнорадикальных и перекисных реакций, сопровождающихся деструкцией ЛП и высвобождением из них белковых соединений, которые разрушаются и/или денатурируются. Проявления • Активация процессов протеолиза и накопление продуктов протеолиза. • Торможение реакций протеосинтеза. • Денатурация молекул белка (образование аутоантигенов). Последствия В очаге воспаления вследствие интенсификации реакций протеолиза и денатурации белков развиваются следующие процессы (рис. 5–5).
Рис. 5–5. Изменения метаболизма белков в очаге воспаления. • Деструкция мембран клеток, повреждённых флогогенным фактором. • Разрушение белковых структур и клеток флогогенного агента, когда им являются микроорганизмы, одно‑ и многоклеточные паразиты, а также — белоксодержащие факторы (вирусы, АТ, комплексы Аг‑АТ, токсины и другие соединения). • Активация иммунных (в том числе — иммунопатологических) реакций в связи с денатурацией белков как собственных погибших клеток, так и флогогенного агента. Включение клеточных и гуморальных механизмов иммунитета обеспечивает обнаружение, деструкцию и элиминацию антигенно чужеродных структур. • Продукты протеолиза служат субстратом синтеза новых клеточных компонентов взамен повреждённых. Ионы и вода Для ионов и воды характерен трансмембранный дисбаланс ионов, увеличение внутриклеточного содержания Na+ и Ca2+ и внеклеточного содержания K+ и Mg2+, гипергидратация клеток и отёк ткани в очаге воспаления. Главные причины • Прямое повреждающее действие флогогенного агента на мембраны клеток. • Нарушения энергетического обеспечения селективного переноса катионов. • Расстройства работы ионообменных механизмов (Н+‑Ca2+, Na+‑Ca2+, H+‑K+). • Снижение кинетической активности катион‑зависимых мембранных АТФаз (Na+,K+‑АТФазы, Ca2+,Mg2+‑АТФазы). • Нарушения физико‑химического состояния и микроструктуры клеточных мембран. Последнее проявляется: † фазным увеличением или снижением степени «жёсткости», а следовательно, и проницаемости мембран для ионов; † дефектами цитоскелета (микрофиламенты, микротрубочки, промежуточные нити, связанные со структурными элементами клеточных мембран). † Образованием микроразрывов (микробрешей, простейших транспортных каналов) в плазмолемме и мембранах клеточных органелл. В совокупности эти изменения сопровождаются потерей клеткой K+, Mg2+, ряда микроэлементов и увеличением их концентрации на внешней поверхности клеточной мембраны. Одновременно с этим повышается внутриклеточное содержание Na+ и Ca2+, а также воды. Проявления • Нарушения распределения ионов по обе стороны плазмолеммы. При этом происходит потеря клеткой K+, Mg2+, микроэлементов и накопление их в межклеточной жидкости. В клетку же поступают Na+, Ca2+ и некоторые другие ионы. • Нарушения соотношения между отдельными ионами как в клетке, так и вне клетки в результате расстройства механизмов трансмембранного переноса ионов. • Гипергидратация ткани в очаге воспаления в связи с высокой гидрофильностью накапливающихся в нём Na+ и Ca2+, а также продуктов гидролиза органических соединений. • Высвобождение дополнительного количества катионов (K+, Na+, Ca2+, железа, цинка) при гидролизе солей, распаде гликогена, белков и других органических соединений, а также — клеточных мембран. • Выход большого количества Ca2+ из повреждённых внутриклеточных депо (например, митохондрий и цистерн эндоплазматической сети и митохондрий). Последствия • Значительное увеличение осмотического давления внутри клеток, набухание клеток и их органелл, перерастяжение и разрыв мембран и в конце концов — гибель клеток. • Расстройства формирования МП и ПД, стойкая деполяризация мембран возбудимых клеток (в особенности кардиомиоцитов), сочетающаяся со снижением их функций и болевой чувствительности в центре очага воспаления (в зоне первичной альтерации). По периферии воспалённой ткани (в зоне вторичной альтерации), как правило, регистрируются более или менее сниженный уровень деполяризации мембран, повышенная возбудимость клеток и высокая болевая чувствительность. Названные выше механизмы дисбаланса ионов и воды действуют не только на клетки организма, но и на флогогенный фактор, что может привести к его повреждению. Расстройства обмена веществ сопровождаются существенными и закономерными физико‑химическими сдвигами в очаге воспаления. Физико‑химические изменения Основные физико‑химические изменения в очаге воспаления приведены на рис. 5–6.
Рис. 5–6. Физико‑химические изменения в очаге воспаления. Ацидоз Воспалительная реакция характеризуется увеличением [Н+] и, соответственно, снижением рН в клетках и межклеточной жидкости — развитием ацидоза. Причина Причина метаболического ацидоза — накопление в очаге воспаления избытка недоокисленных соединений. Механизмы развития метаболического ацидоза • Образование большого количества «кислых» продуктов изменённого метаболизма вследствие: † активации гликолиза, что сопровождается накоплением избытка молочной и пировиноградной кислот † усиления протеолиза и липолиза с накоплением аминокислот, ВЖК и КТ. • Нарушение оттока из очага воспаления продуктов как нормального, так и нарушенного обмена веществ. Последнее особенно выражено в связи с замедлением оттока венозной крови и развитием стаза в очаге воспаления. • «Истощение» щелочных буферных систем (бикарбонатной, фосфатной, белковой и других) клеток и межклеточной жидкости, которые на начальном этапе воспаления нейтрализуют избыток кислых соединений. Особенности изменения [Н+] в очаге воспаления • Чем острее протекает воспаление, тем более выражен ацидоз: из компенсированного он быстро трансформируется в некомпенсированный. • Как правило, [Н+] наибольшая в зоне первичной альтерации, она меньше в прилегающей к ней зоне вторичной альтерации и постепенно снижается по направлению к неповреждённой ткани. • В отдельных участках интенсивной деструкции и аутолиза тканей, где накапливаются восстановленные органические и неорганические соединения, продукты промежуточного белкового распада (аммиак и его производные), может развиваться более или менее выраженный преходящий алкалоз. Однако, в целом для очага воспаления характерен ацидоз. Последствия ацидоза Последствия метаболического ацидоза в очаге воспаления приведены на рис. 5–7.
Рис. 5–7. Эффекты ацидоза в очаге воспаления. • Повышение проницаемости клеточных мембран, в том числе плазмолеммы и лизосом приводит к выходу гидролаз в цитозоль и межклеточное вещество. • Активация лизосомальных ферментов сопровождается усилением деструкции клеточных и неклеточных структур в очаге воспаления. • Повышение проницаемости стенок сосудов за счёт усиления неферментного и ферментного гидролиза компонентов межклеточного матрикса, включая базальные мембраны. • Формирование ощущения боли в очаге воспаления в связи с раздражением и повреждением чувствительных нервных окончаний в условиях избытка Н+. • Усиление гидролиза солей и органических соединений ведёт к повышению осмотического и онкотического давления, изменяет коллоидное состояние цитозоля. • Изменения чувствительности рецепторных структур клеток (в том числе — стенок микрососудов) к регуляторным факторам (гормонам, нейромедиаторам, другим БАВ) сопровождаются нарушениями регуляции тонуса сосудистой стенки. Так, на стадии альтерации в очаге воспаления, как правило, снижается чувствительность рецепторов к адреномиметикам (в частности, к норадреналину) и повышается к холиномиметическим агентам. Гиперосмия В очаге воспаления в большей или меньшей мере повышается осмотическое давление. Причины • Повышенное ферментативное и неферментное разрушение макромолекул (гликогена, гликозаминогликанов, протеогликанов и других). • Усиленный в условиях ацидоза гидролиз солей и соединений, содержащих неорганические вещества. • Поступление осмотически активных соединений из повреждённых и разрушенных клеток. Последствия • Гипергидратация очага воспаления. • Повышение проницаемости сосудистых стенок. • Стимуляция эмиграции лейкоцитов. • Изменение тонуса стенок сосудов и кровообращения в очаге воспаления. • Формирование чувства боли. Гиперонкия Увеличение онкотического давления в воспалённой ткани — закономерный феномен. Причины • Увеличение концентрации белка в очаге воспаления в связи с усилением ферментативного и неферментного гидролиза пептидов. • Повышение гидрофильности белковых мицелл и других коллоидов в результате изменения их конформации при взаимодействия с ионами. • Выход белков (в основном — альбуминов) из крови в очаг воспаления в связи с повышением проницаемости стенок микрососудов. Последствия Основное: развитие отёка в очаге воспаления.
Поиск по сайту: |