|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
СИДЕРОАХРЕСТИЧЕСКАЯ АНЕМИЯ
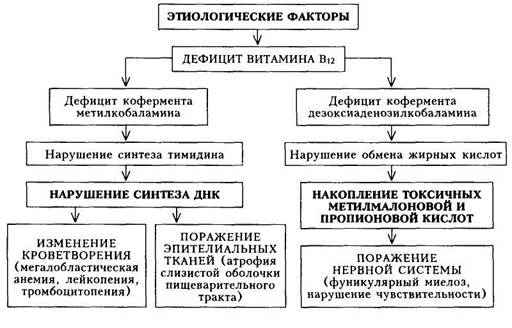
Сидероахрестическая анемия (САА) — железонасыщенная или сидеробластная анемия, при которой эритроциты содержат мало железа (гипохромны) вследствие неиспользования его костным мозгом для синтеза гемоглобина. Этиология и патогенез.В основе развития сидероахрестических анемий лежит нарушение синтеза гема. Железо, белок, необходимые для синтеза гемоглобина, имеются, однако отсутствует достаточное количество протопорфирина. Вследствие этого не осуществляется синтез гема — основного компонента молекулы гемоглобина. Гем — соединение порфири-новых колец (протопорфирина) с атомом железа. Гем, соединяясь с глобином, образует молекулу гемоглобина. При САА уменьшается образование порфиринов и возникает избыток железа. Уменьшение образования порфиринов обусловлено врожденным или приобретенным дефицитом ряда ферментов. Накопление железа в организме приводит к отложению его во внутренних органах. Выделяют две основные наследственные формы САА: пиридоксинза-висимую (имеется дефицит пиридоксаль-фосфата, поэтому назначение пи-ридоксина — витамина Be — дает эффект) и пиридоксинрезистентную (этачформа встречается крайне редко). Приобретенные формы чаще наблюдаются в пожилом возрасте, заболевание не носит семейного характера. Непосредственный ферментный дефект не всегда ясен. САА чаще возникает при лечении туберкулостатичес-кими препаратами вследствие истощения запасов пиридоксаль-фосфата, при свинцовой интоксикации. Могут быть также идиопатические формы САА. Клиническая картина.При наследственных формах заболевание начинается уже в раннем детстве. На I этапе диагностического поиска выявляются жалобы, обусловленные гипоксически-циркуляторным синдромом. В анамнезе — указания на бледность, слабость, увеличение печени и селезенки. Дети быстро устают, плохо учатся, у них плохая память; у взрослых — слабость, снижение толерантности к физической нагрузке, возникающие после длительного лечения основного заболевания (туберкулеза), профессиональных вредностей (контакт со свинцом). Можно обна- 15 - 540 ружить сведения о выявлении низких показателей гемоглобина и неуспешном лечении препаратами железа. На II этапе диагностического поиска в периоды обострения возможно выявление бледности кожных покровов и видимых слизистых оболочек, у части больных — увеличение печени и селезенки в умеренных пределах. В связи с этим у таких больных предполагают хроническое заболевание печени (чаще всего хронический гепатит). Отложение железа во внутренних органах может привести к ряду своеобразных симптомов. Так, отложение железа в поджелудочной железе ведет к сахарному диабету, в печени — к циррозу печени, в сердце — к сердечной недостаточности, в половых железах — к евнухоидизму. Для постановки диагноза основным является III этап диагностического поиска. Лабораторные исследования выявляют снижение гемоглобина в сочетании с низким цветовым показателем, ретикулоцитопе-нию. В сыворотке крови определяют высокое содержание железа, а в пунктате костного мозга — сидеробласты (клетки костного мозга с включениями железа в виде гранул). Дефицит ферментов, участвующих в обмене порфиринов, уточняют путем определения продуктов порфиринов в моче. Повышенное содержание железа в организме доказывается также с помощью десфераловой пробы (после введения десферала с мочой выделяется увеличенное количество железа). При биопсии печени, селезенки можно обнаружить признаки гемосидероза. ОЖСС у таких больных снижена. Лечение.Назначение препаратов железа неэффективно, но еще больше увеличивает содержание железа в крови и способствует гемосидерозу органов. Точно так же не показаны и гемотрансфузии. Применяется пири-доксин (витамин В6) в дозах 50 — 200 мг/сут внутрь или по 100 мг внутримышечно 2 раза в неделю в течение 2 мес. Наиболее эффективен кофер-мент пиридоксаль-фосфат, так как иногда бывает блокирована возможность перехода пиридоксина в пиридоксаль-фосфат. При наследственных формах лечение витамином Вб надо повторять периодически. В случае ре-зистентности к терапии пиридоксином применяют анаболические и андро-генные гормоны. Для уменьшения гемосидероза органов и снижения уровня сывороточного железа назначают десферал (внутривенно по 500 — 1000 мг) с перерывами, ориентируясь на уровень железа и присутствие сидероблас-тов в костном мозге. В12-ДЕФИЦИТНАЯ АНЕМИЯ Сущность Biz-дефицитной анемии (В12ДА) состоит в нарушении образования дезоксирибонуклеиновой кислоты (ДНК) в связи с нехваткой в организме витамина Bi2 (цианокобаламина), что приводит к нарушению кроветворения, появлению в костном мозге мегалобластов, внутри-костномозговому разрушению эритрокариоцитов, снижению количества эритроцитов и гемоглобина, лейкопении, нейтропении и тромбоцитопении, а также к изменению ряда органов и систем (пищеварительный тракт, ЦНС). Этиология.В12ДА встречается значительно реже, чем ЖДА, и может быть вызвана следующими причинами: 1) нарушением секреции гастромукопротеина («внутренний фактор») 2) повышением расхода витамина Bi2 (инвазия широкого лентеца, ак 3) нарушением всасывания витамина Bi2 (органические заболевания 4) нарушением транспорта витамина Вп (дефицит транскобаламина); 5) образованием антител к «внутреннему фактору» или комплексу Сходную с В12ДА гиперхромную анемию вызывает дефицит фолиевой кислоты, который возникает при: 1) повышенном расходе (беременность); 2) вскармливании детей козьим молоком; 3) нарушении всасывания (органические заболевания кишечника, алкоголизм); 4) приеме некоторых лекарственных препаратов (противосудорожные, противотуберкулезные препараты, фенобарбитал, контрацептивы и др.). Патогенез.Витамин В(2 состоит из двух коферментов — метилкоба-ламина и дезоксиаденозилкобаламина. Дефицит первого кофермента обусловливает нарушение синтеза ДНК, вследствие чего деление и созревание клеток красного ряда нарушаются, они избыточно растут, не утрачивая ядра. Большие клетки, содержащие ядра, называются мегалобласта-ми, они не созревают до мегалоцитов (гигантские эритроциты без ядер), легко гемолизируются, еще находясь в костном мозге. Дефицит витамина В(2 вызывает нарушение роста клеток лейкоцитарного и тромбоцитарного рядов, но это не так заметно сказывается на морфологии и количестве клеток, как нарушения эритропоэза. При недостатке второго кофермента нарушается обмен жирных кислот, вследствие чего в организме происходит накопление токсичных продуктов пропионовой и метилмалоновой кислот: развивается поражение заднебоко-вых канатиков спинного мозга — фуникулярный миелоз (схема 26). Клиническая картина.Проявления В^ДА, как это вытекает из схемы патогенеза, складываются из следующих синдромов: 1) циркуляторно-ги-поксического (при достаточной выраженности анемии и кислородного голодания тканей); 2) гастроэнтерологического; 3) неврологического; 4) гематологического (анемия гиперхромного типа). Кроме этих синдромов, клиническая картина будет определяться также заболеванием, на основе которого развилась В^ДА. На I этапе диагностического поиска при достаточно выраженной анемии могут наблюдаться симптомы, обусловленные циркуляторно-ги-поксическим синдромом (слабость, повышенная утомляемость, одышка при физической нагрузке, болевые ощущения в области сердца, сердцебиения). В случае нерезкого кислородного голодания тканей эти жалобы могут отсутствовать. Снижение аппетита, отвращение к мясу, боли в кончике языка и жжение, чувство тяжести в эпигастрии после еды, чередование поносов и запоров обусловлены поражением пищеварительного тракта и, в частности, выраженной секреторной недостаточностью желудка. При поражении ЦНС больные жалуются на головную боль, неустойчивую походку, зябкость, чувство онемения в конечностях, ощущение «ползания
мурашек». Выраженность этих жалоб не всегда соответствует степени анемии, в период ремиссии заболевания жалобы могут отсутствовать. Весьма существенно, если все перечисленные жалобы предъявляет немолодой человек, в этих случаях вероятность В12ДА повышается. В семейном анамнезе у больных с предполагаемой В12ДА могут быть больные с данным заболеванием. Злоупотребление алкоголем может быть одной из причин развития анемии. Данные анамнеза могут помочь в предположении патогенетического варианта анемии. Развитие анемии после пребывания больного возле больших водоемов и употребления в пищу сырой или недостаточно обработанной рыбы заставляет предположить в качестве возможной причины дифилло-ботриоз. Если заболевание возникло у пожилого человека, страдающего хроническим гастритом, и развивается медленно, то можно думать о В12ДА. В случае, если симптомы со стороны пищеварительного тракта сочетаются со снижением массы тела и быстро прогрессируют, следует предположить в качестве причины заболевания злокачественное новообразование. Наконец, сведения об успешном лечении больного витамином Bf2 позволяют с большой уверенностью рассматривать имеющуюся симптоматику как проявление В^ДА. На II этапе диагностического поиска симптомы могут быть обусловлены поражением пищеварительного тракта и ЦНС. Кроме того, ряд неспецифических признаков повышает вероятность предположения о наличии у больного В12ДА. Так, бледность кожных покровов в сочетании с небольшой иктеричностью склер и одутловатостью лица наблюдается при В12ДА. Масса тела таких больных, как правило, нормальная или повышенная. Однако снижение массы тела может указывать на злокачествен- ную опухоль как возможную причину ВпДА. Аналогичное значение имеет обнаружение увеличенного плотного лимфатического узла (метастаз опухоли?). Циркуляторно-гипоксический синдром проявляется так же, как и при ЖДА (расширение границ сердца влево, тахикардия, систолический шум, шум «волчка» на яремных венах). Несомненное диагностическое значение имеет обнаружение при исследовании пищеварительного тракта признаков глоссита: сглаженные сосочки вплоть до полной их атрофии («полированный» язык). Печень несколько увеличена, может прощупываться селезенка. Однако все эти симптомы не являются обязательными для В12ДА. Отмечаются нарушения глубокой чувствительности, нижний спастический парапарез (картина псевдотабеса). Следует заметить, что изменения нервной системы наблюдаются далеко не во всех случаях, так что их отсутствие не исключает диагноза В12ДА. Таким образом, данные II этапа в сочетании с анамнестическими данными и жалобами больного, хотя и выявляют ряд основных симптомов В12ДА, но дают основание лишь заподозрить эту форму болезни. Окончательный диагноз ставят после проведения серии лабораторных исследований. На III этапе диагностического поиска при исследовании периферической крови выявляют следующие признаки: снижение количества эритроцитов (менее 31012/л), повышение цветового показателя (более 1,1), среднего содержания гемоглобина в эритроците (более 34 пг) и среднего объема эритроцита (более 120 мкм3). Эритроцитометрическая кривая сдвинута вправо — увеличено количество макроцитов, появляются мега-лоциты — эритроциты диаметром более 12 мкм. Форма эритроцитов изменена — пойкилоцитоз. Встречаются единичные мегалобласты. Дополнительный признак — появление нейтрофилов с гиперсегмен-тированными ядрами. Если в картине периферической крови не обнаруживают характерных признаков, то производят стерналъную пункцию. Последняя позволяет выявить в костном мозге мегалобластический тип кроветворения. Важным является определение содержания сывороточного железа: при ВпДА оно может быть в норме или повышено в связи с усиленным гемолизом эритроцитов. В этих случаях увеличено содержание непрямого билирубина. При исследовании желудочного сока часто выявляется гиста-миноустойчивая ахилия (характерный признак анемии Аддисона — Бирме-ра), эндоскопически — атрофия слизистой оболочки желудка. Другие инструментальные методы исследования помогают обнаружить признаки миокардиодистрофии (развивается на фоне выраженной анемии), а также уточнить этиологию заболевания. Диагностика. В диагностике В12ДА выделяют два этапа: 1) доказательство дефицита витамина Вп как причины анемии; 2) выявление причин дефицита витамина Bi2. Критериями ВпДА являются: 1) снижение содержания эритроцитов (менее 3,0-1012/л); 2) повышение цветового показателя (более 1,1); 3) повышение содержания гемоглобина в эритроцитах (более 34 пг); 4) увеличение среднего объема эритроцита (более 120 мкм3); 5) сдвиг эритроцитомет-рической кривой вправо (увеличение количества макроцитов, появление ме-галоцитов — эритроцитов диаметром более 12 мкм); 6) появление в мазках пунктата костного мозга элементов мегалобластного кроветворения; 7) по- вышение содержания сывороточного железа (более 30,4 мкмоль/л); 8) снижение радиоактивности мочи после приема витамина Bi2, меченного радиоактивным кобальтом. Для выявления причины анемии следует проводить рентгенологическое и эндоскопическое исследование пищеварительного тракта (опухоль желудка, дивертикулез тонкой кишки), гельминтологическое исследование (инвазия широким лентецом), функциональное исследование печени с биопсией (хронический гепатит, цирроз), исследование нейтрального жира в кишечнике (спру). В12ДА следует дифференцировать от фолиеводефицитной анемии. При дефиците фолиевой кислоты наблюдается макроцитарная гиперхром-ная анемия, а в костном мозге могут обнаруживаться мегалобласты. Следует отметить, что дефицит фолиевой кислоты встречается значительно реже. В отличие от В12ДА при фолиеводефицитной анемии содержание фолиевой кислоты в сыворотке, а также в эритроцитах снижено. Кроме того, при окраске препарата костного мозга ализарином красным окрашиваются только мегалобласты, связанные с дефицитом В^, и не окрашиваются мегалобласты, связанные с дефицитом фолиевой кислоты. Течение. Заболевание может резко обостриться. В таких случаях развивается коматозное состояние: потеря сознания, снижение температуры тела и АД, одышка, рвота, арефлексия, непроизвольное мочеиспускание. Между развитием коматозного состояния и падением уровня гемоглобина нет четких коррелятивных отношений (у больных с резко сниженным содержанием гемоглобина не наблюдается комы). Главную роль в патогенезе комы играют быстрый темп и степень снижения гемоглобина, резкая ишемия и гипоксия ЦНС. Формулировка развернутого клинического диагнозаучитывает: 1) этиологию В12ДА (отдельно следует выделять такую форму анемии, как болезнь Аддисона — Бирмера); 2) стадию процесса (рецидив — ремиссия); 3) выраженность отдельных синдромов (обычно при наличии неврологических расстройств, обусловленных фуникулярным миелозом). Лечение.Комплекс лечебных мероприятий при В12ДА следует проводить с учетом этиологии, выраженности анемии и наличия неврологических нарушений. При лечении следует ориентироваться на следующие положения: • Непременным условием лечения В12ДА при глистной инвазии явля • При органических заболеваниях кишечника и поносах следует при • Нормализация кишечной флоры достигается приемом ферментных • Сбалансированное питание с достаточным содержанием витаминов • Патогенетическая терапия осуществляется с помощью парентерального введения витамина Bi2 (ликвидация его дефицита), а также нормализации измененных показателей центральной гемодинамики и нейтрализации антител к гастромукопротеину («внутреннему фактору») или комплексу гастромукопротеин + витамин В^ (корти-костероидная терапия). Цианкобаламин (витамин Вп) вводят ежедневно внутримышечно в дозе 200 — 500 мкг 1 раз в день в течение 4 — 6 нед до наступления гематологической ремиссии. Критериями гематологической реакции являются резкое увеличение количества ретикулоцитов в периферической крови — ретикулоцитарный криз, трансформации мегалобластического кроветворения в нормобласти-ческое. Появление ретикулоцитарного криза на 5 —б-й день лечения является ранним критерием эффективности его. В процессе лечения цианкобаламином количество эритроцитов нарастает быстрее, чем содержание гемоглобина, в связи с этим цветовой показатель обычно снижается. После нормализации костномозгового кроветворения и состава крови (обычно через 1,5 — 2 мес) витамин вводят 1 раз в неделю в течение 2 — 3 мес, затем в течение полугода 2 раза в месяц в тех же дозах, что и в начале курса). В дальнейшем больных ставят на диспансерный учет; профилактически им вводят витамин Bi2 1 — 2 раза в год короткими курсами по 5 — 6 инъекций или ежемесячно по 200 — 500 мкг (пожизненно). При симптомах фуникулярного миелоза витамин Вп вводят в значительных дозах — 500 — 1000 мкг ежедневно в течение 10 дней, а затем 1—3 раза в неделю до исчезновения неврологической симптоматики. Гемотрансфузии проводят лишь при значительном снижении гемоглобина и проявлении симптомов коматозного состояния. Рекомендуется вводить эритроцитную массу по 250 — 300 мл (5 — 6 трансфузий). Преднизолон (20 — 30 мг/сут) рекомендуется при аутоиммунной природе заболевания. Прогноз.В настоящее время применение витамина Bt2 сделало прогноз В12ДА благоприятным. При адекватной терапии больные живут длительное время. Профилактика.Мер первичной профилактики не существует. У лиц, имеющих перечисленные ранее этиологические факторы, следует периодически исследовать кровь для своевременного выявления анемии. ГЕМОЛИТИЧЕСКИЕ АНЕМИИ Гемолитические анемии (ГА) составляют обширную группу заболеваний, значительно различающихся по этиологии, патогенезу, клинической картине и лечению. Основным патологическим процессом, объединяющим эти заболевания в одну группу, является повышенный гемолиз. Гемолиз может происходить внутриклеточно (в селезенке как обычный физиологический), так и непосредственно в сосудах (внутрисосудистый или внеклеточный). В норме продолжительность жизни эритроцита составляет 100—120 дней, а при гемолитических анемиях она сокращается до 12—14 дней. Повышенный гемолиз, происходящий в клетках мононуклеарно-фаго-цитарной системы (главным образом в селезенке) проявляется следующими симптомами: ■ в крови увеличивается содержание свободного (непрямого) билиру ■ избыточное количество непрямого билирубина перерабатывается ге- ■ в кишечнике, куда поступает желчь, образуются в увеличенном ко ■ в моче увеличивается содержание уробилина; ■ общее количество эритроцитов уменьшается, увеличивается ретику- Проявления повышенного гемолиза, происходящего в сосудах: ■ в крови увеличивается количество свободного гемоглобина; ■ свободный гемоглобин выделяется с мочой в неизмененном виде ■ гемосидерин может откладываться во внутренних органах (гемоси- Классификация.Все ГА делятся на две большие группы — наследственные и приобретенные. Наследственные ГА обусловлены генетическими дефектами эритроцитов, которые становятся функционально неполноценными и легко разрушаются. Приобретенные ГА являются следствием воздействия на нормальные эритроциты различных факторов, приводящих их к разрушению (образование антител, гемолитических ядов, механические воздействия и пр.). Наследственные ГА: 1) связанные с нарушением мембраны эритроцитов (гемолитическая микросфероцитарная анемия или болезнь Минков-ского — Шоффара, овалоцитоз, стоматоцитоз); 2) связанные с нарушением активности ферментов в эритроцитах 3) связанные с нарушением структуры или синтеза цепей глобина (та- Приобретенные ГА: 1) связанные с воздействием антител (изоиммун-ные, аутоиммунные); 2) связанные с изменением структуры мембраны эритроцитов вслед 3) связанные с механическим повреждением мембраны эритроцита 4) обусловленные химическими повреждениями эритроцитов (гемо 5) обусловленные недостатком витамина Е; 6) связанные с воздействием паразитов (малярия). Частота тех или иных ГА весьма различна. Так, наследственный микросфероцитоз в Европе встречается с частотой 0,03 %, а в Японии и Африке значительно реже; частота анемии, обусловленная дефицитом Г-6-ФД, высока в странах Средиземноморского бассейна, на Ближнем Востоке и на Кавказе; ночная пароксизмальная гемоглобинурия представляет собой редкое заболевание. Далее рассматривается диагностический поиск при трех видах ГА, встречающихся наиболее часто: наследственном микросфе-роцитозе, талассемии и аутоиммунной ГА.
Поиск по сайту: |