|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
СИМПТОМАТИЧЕСКИЕ АРТЕРИАЛЬНЫЕ ГИПЕРТЕНЗИИ
Симптоматические,или вторичные, артериальные гипер-тензии (СГ) — это АГ, причинно связанные с определенными заболеваниями или повреждениями органов (или систем), участвующих в регуляции АД. Частота симптоматических артериальных гипертензий составляет 5 — 15 % от всех больных АГ. Классификация.Существует множество классификаций СГ, однако выделяют четыре основные группы СГ. I. Почечные (нефрогенные). II. Эндокринные. III. Гипертензий, обусловленные поражением сердца и крупных арте IV. Центрогенные (обусловленные органическим поражением нерв Возможно сочетание нескольких (чаще двух) заболеваний, потенциально способных привести к АГ, например: диабетический гломерулоскле-роз и хронический пиелонефрит; атеросклеротический стеноз почечных артерий и хронический пиело- или гломерулонефрит; опухоль почки у пациента, страдающего атеросклерозом аорты и мозговых сосудов и т.п. К основным группам С Г некоторые авторы относят и экзогенно обусловленные АГ [Кушаковский М.С., 1983; Гогин Е.Е. и др., 1997]. В эту группу входят АГ, развившиеся в результате отравлений свинцом, таллием, кадмием и т.д., а также лекарственными средствами (глюкокортикоиды, контрацептивные средства, индометацин в сочетании с эфедрином и др.). Однако и с приведенными добавлениями классификация не является исчерпывающей. Существует АГ при полицитемии, хронических обструк-тивных заболеваниях легких и прочих состояниях, не вошедших в классификацию. В настоящем разделе рассмотрены четыре основные группы СГ. Этиология.Этиологическими факторами для СГ являются многочисленные заболевания, сопровождающиеся развитием АГ как симптома. Описано более 70 подобных заболеваний. • Заболевания почек, почечных артерий и мочевыводящей системы: а) приобретенные: диффузный гломерулонефрит, хронический пи б) врожденные: гипоплазия, дистопия, аномалии развития почеч • Заболевания эндокринной системы: феохромоцитома и феохромо- • Заболевания сердца, аорты и крупных сосудов: а) пороки сердца приобретенные (недостаточность клапана аорты б) поражения аорты врожденные (коарктация) и приобретенные • Заболевания ЦНС: опухоль мозга; энцефалит; травмы; очаговые Реноваскулярные (вазоренальные) АГ относятся к почечным СГ. Патогенез.Механизм развития С Г при каждом заболевании имеет отличительные черты. Они обусловлены характером и особенностями развития основного заболевания. Так, при почечной патологии и реноваскуляр-ных поражениях пусковым фактором является ишемия почки, а доминирующим механизмом повышения АД — рост активности прессорных и снижение активности депрессорных почечных агентов. При эндокринных заболеваниях первично повышенное образование некоторых гормонов является непосредственной причиной повышения АД. Вид гиперпродуцируемого гормона — альдостерон или другой минерал окортикоид, катехоламины, СТГ, АКТГ и глюкокортикоиды — зависит от характера эндокринной патологии. При органических поражениях ЦНС создаются условия для ишемии центров, регулирующих АД, и нарушений центрального механизма регуляции АД, вызванного не функциональными (как при гипертонической болезни), а органическими изменениями. При гемодинамических СГ, обусловленных поражением сердца и крупных артериальных сосудов, механизмы повышения АД не представляются едиными и определяются характером поражения. Они связаны: 1) с нарушением функции депрессорных зон (синокаротидной зоны), 2) с переполнением кровью сосудов, расположенных выше места су 3) с сужением сосудов в ответ на уменьшение сердечного выброса, уве 4) с увеличением и ускорением систолического выброса крови в аорту Клиническая картина.Клинические проявления при С Г в большинстве случаев складываются из симптомов, обусловленных повышением АД, и симптомов основного заболевания. • Повышением АД можно объяснить головные боли, головокруже • Симптомы основного заболевания:
1) могут быть ярко выраженными, в таких случаях характер СГ ус 2) могут отсутствовать, заболевание проявляется только повышени а) развитии АГ у лиц молодого возраста и старше 50 — 55 лет; б) остром развитии и быстрой стабилизации АГ на высоких циф в) бессимптомном течении АГ; г) резистентности к гипотензивной терапии; д) злокачественном характере течения АГ. По характеру течения СГ, как и гипертоническую болезнь, разделяют на доброкачественные и злокачественные формы. Синдром злокачественной АГ встречается в 13 —30 % всех СГ. Различная выраженность симптомов и широкий круг заболеваний, сопровождающихся АГ, обусловливают чрезвычайную вариабельность клинической картины С Г. В связи с этим этапы диагностического поиска будут представлены отдельно для каждой группы заболеваний, выделенных в классификации. Почечные (нефрогенные) гипертензии.Почечные АГ — наиболее частая причина СГ (70 — 80 %). Они подразделяются на АГ при заболеваниях паренхимы почек, реноваскулярные (вазоренальные) гипертензии и АГ, связанные с нарушением оттока мочи. Большую часть почечных АГ представляют заболевания с ренопаренхиматозной и вазоре-нальной патологией. Клиническая картина многочисленных заболеваний, сопровождающихся АГ почечного генеза, может проявляться следующими синдромами: АГ и патологией мочевого осадка; АГ и лихорадкой; АГ и шумом над почечными артериями; АГ и пальпируемой опухолью брюшной полости; АГ (моносимптомно). Эти синдромы могут быть выявлены на разных этапах диагностического поиска. В задачу I этапа диагностического поиска входят: 1) сбор сведений о перенесенных ранее заболеваниях почек или мочевыводящей системы; 2) целенаправленное выявление жалоб, встречающихся при почечной патологии, при которой гипертензия может выступать как симптом. Указания на имеющуюся у больного патологию почек (гломеруло- и пиелонефрит, мочекаменная болезнь и т.д.), связь ее с развитием АГ позволяют сформулировать предварительную диагностическую концепцию. При отсутствии характерного анамнеза наличие жалоб на изменение цвета и количества мочи, дизурические расстройства, появление отеков помогает связать повышение АД с почечной патологией без определенных высказываний о характере поражения почек. Эти сведения необходимо получить на последующих этапах обследования больного. Если больной предъявляет жалобы на лихорадку, боли в суставах и животе, повышение АД, то можно заподозрить узелковый периартериит — заболевание, при котором почки являются лишь одним из органов, вовлеченных в процесс. Сочетание повышенного АД с лихорадкой характерно для инфекции мочевыводящих путей (жалобы на дизурические расстройства), встречается также при опухолях почек. На данном этапе в ряде случаев можно получить сведения, указывающие лишь на повышение АД. Следует учитывать возможность существования моносимптомных почечных АГ, поэтому возрастает значение последующих этапов обследования больного для выявления причины повышения АД. На II этапе диагностического поиска выявляют симптомы, обусловленные повышением АД (описаны ранее) и основным заболеванием. Наличие выраженных отеков при соответствующем анамнезе делает предварительный диагноз гломерулонефрита более достоверным. Возникают предположения и об амилоидозе. При физикальном обследовании больного может быть обнаружен систолический шум над брюшной аортой у места отхождения почечных артерий, тогда можно предположить реноваскулярный характер АГ. Уточненный диагноз ставят по данным ангиографии. Обнаружение при пальпации живота опухолевого образования у больных АГ позволяет предположить поликистоз почек, гидронефроз или гипернефрому. Таким образом, на II этапе диагностического поиска могут возникнуть новые предположения о заболеваниях, обусловивших развитие АГ, а также подтвердиться диагностические концепции I этапа. Завершить первые два этапа обследования необходимо формулировкой предварительного диагноза. Это делается для того, чтобы из огромного количества исследований, предполагаемых на III этапе, выбрать необходимые именно данному больному для постановки окончательного диагноза. На основании оценки выявленных синдромов можно высказать следующие предположения о заболеваниях, сопровождающихся АГ почечного генеза. • Сочетанием АГ с патологией мочевого осадка проявляется: а) хро • Сочетание АГ и лихорадки наиболее часто встречается при: а) хро • Сочетание АГ с пальпируемой опухолью в брюшной полости наблю • Сочетанием АГ с шумом над почечными артериями характеризуется • Моносимптомная АГ характерна для: а) фибромускулярной гипер На III этапе диагностического поиска производят: а) обязательное обследование всех больных (см. «Гипертоническая болезнь»); б) специальные исследования по показаниям. Исследования по показаниям включают: 1) количественную оценку бактериурии, суточную потерю белка с 2) суммарное исследование функции почек; 3) раздельное исследование функции обеих почек (изотопная рено- 4) ультразвуковое сканирование почек; 5) компьютерную томографию почек; 6) контрастную ангиографию (аортография с исследованием почечно 7) исследование крови на содержание ренина и ангиотензина. Показания к проведению того или иного дополнительного исследования зависят от предварительного диагностического предположения и результатов рутинных (обязательных) методов обследования. Уже по результатам обязательных методов исследования (характер мочевого осадка, данные бактериологического исследования) можно иногда подтвердить предположение о гломеруло- или пиелонефрите. Однако для окончательного решения вопроса нужны дополнительные исследования. Эти исследования включают анализ мочи по Нечипоренко, посев мочи по Гулду (с качественной и количественной оценкой бактериурии), проведение преднизолоновой пробы (провокация лейкоцитурии после внутривенного введения преднизолона), изотопной ренографии и сканирования, хромоцистоскопии и ретроградной пиелографии. Кроме того, следует безупречно выполнить инфузионную урографию. В сомнительных случаях для окончательного диагноза латентно протекающего пиелонефрита или гломерулонефрита производят биопсию почки. Нередко патологический процесс в почках многие годы протекает скрыто и сопровождается минимальными и непостоянными изменениями мочи. Небольшая протеинурия приобретает диагностическое значение только при учете суточного количества теряемого с мочой белка: протеи- * нурию более 1 г/сут можно рассматривать как косвенное указание на связь АГ с первичным поражением почек. Экскреторная урография исключает (или подтверждает) наличие камней, аномалий развития и положения почек (иногда почечных сосудов), которые могут быть причиной макро- и микрогематурии. При гематурии для исключения опухоли почек, помимо экскреторной урографии, проводят сканирование почек, компьютерную томографию и на завершающем этапе — контрастную ангиографию (аорто- и кавогра-фия). Диагноз интерстициального нефрита, также проявляющегося микрогематурией, может быть поставлен только с учетом результатов биопсии почек. Биопсия почки и гистологическое исследование биоптата позволяют окончательно подтвердить диагноз амилоидного ее поражения. В случае предположения о вазоренальной гипертензии установить ее характер можно по данным контрастной ангиографии. Эти исследования — биопсия почки и ангиография — проводятся по строгим показаниям. Ангиографию проводят больным молодого и среднего возраста при стабильной диастолической АГ и неэффективности лекарственной терапии (небольшое снижение АД наблюдается только после применения массивных доз препаратов, действующих на разные уровни регуляции АД). Данные ангиографии трактуются следующим образом: 1) односторонний стеноз артерии, устья и средней части почечной ар 2) чередование на ангиограмме участков стеноза и дилатации пора 3) двустороннее поражение почечных артерий от устьев и до средней Эндокринные гипертензии.Среди эндокринных заболеваний, сопровождающихся АГ, не рассматривается диффузный токсический зоб, так как АГ при нем не вызывает сложностей в диагностике, а по своему механизму является преимущественно гемодинамической. Клиническая картина других эндокринных заболеваний, протекающих с повышением АД, может быть представлена в виде следующих синдромов: АГ и симпатико-адреналовые кризы; АГ с мышечной слабостью и мочевым синдромом; АГ и ожирение; АГ и пальпируемая опухоль в брюшной полости (редко). Выявление этих синдромов на разных этапах диагностического поиска позволяет предположительно высказаться об эндокринном генезе АГ. Hal этапе диагностического поиска жалобы больного на возникновение гипертонических кризов, сопровождающихся приступами сердцебиений, мышечной дрожью, профузными потами и бледностью кожных покровов, головными болями, болями за грудиной, позволяют говорить о феохромоцитоме. Если перечисленные жалобы возникают на фоне лихорадки, похудания (проявление интоксикации), сопровождаются болями в животе (метастазы в регионарные забрюшинные лимфатические узлы?), вероятно предположение о феохромобластоме. Вне кризов АД может быть нормальным или повышенным. Склонность к обморокам (особенно при вставании с постели) на фоне постоянно высокого АД также характерна для феохромоцитомы, протекающей без кризов. Жалобы больного на повышение АД и приступы мышечной слабости, снижение физической выносливости, жажду и обильное мочеиспускание, особенно в ночные часы, создают классическую клиническую картину первичного гиперальдостеронизма (синдром Конна) и выявляют возможную причину АГ уже на I этапе диагностического поиска. Сочетание приведенных симптомов с лихорадкой и болями в животе делает вероятным предположение об аденокарциноме надпочечника. Если больной предъявляет жалобы на увеличение массы тела, совпадающее по времени с развитием АГ (при алиментарном ожирении, как правило, увеличение массы тела происходит задолго до развития АГ), нарушения в половой сфере (дисменорея у женщин, угасание либидо у мужчин), то можно предположить синдром или болезнь Иценко —Кушинга. Предположение подкрепляется, если больного беспокоят жажда, поли-урия, кожный зуд (проявление нарушений углеводного обмена). Таким образом, I этап диагностического поиска является очень информативным для диагностики эндокринных заболеваний, сопровождающихся АГ. Сложности возникают при феохромоцитоме, не сопровождающейся кризами. В данной ситуации диагностическое значение последующих этапов, особенно III, чрезвычайно возрастает. На II этапе диагностического поиска физикальные методы обследования позволяют выявить: а) изменения сердечно-сосудистой системы, развивающиеся под влия б) преимущественное отложение жира на туловище при относительно в) слабость мышц, вялые параличи, судороги, характерные для син г) округлое образование в животе (надпочечник). Уточнение характе Необходимо провести провокационный тест: бимануальная пальпация области почек поочередно в течение 2 — 3 мин может вызвать катехолами-новый криз при феохромоцитоме. Отрицательные результаты этой пробы не исключают феохромоцитомы, так как она может иметь вненадпочечни-ковое расположение. III этап диагностического поиска приобретает решающее значение, поскольку позволяет: а) поставить окончательный диагноз; б) выявить локализацию опухоли; в) уточнить ее характер; г) определить тактику лечения. Уже при проведении обязательных исследований обнаруживаются характерные изменения: лейкоцитоз и эритроцитоз в периферической крови, гипергликемия и гипокалиемия; стойкая щелочная реакция мочи (вследствие высокого содержания калия), характерная для первичного гипераль-достеронизма. При развитии «гипокалиемической нефропатии» выявляются полиурия, изостенурия, никтурия при исследовании мочи по Зимниц-кому. Из дополнительных методов исследования для выявления или исключения первичного альдостеронизма производят: 1) исследование суточного выделения калия и натрия в моче с подсче 2) определение содержания калия и натрия в плазме крови до и после 3) определение щелочного резерва крови (выраженный алкалоз при 4) определение содержания альдостерона в суточной моче (увеличено 5) определение уровня ренина в плазме крови (понижение активности Решающее значение для диагностики всех опухолей надпочечника имеют данные следующих исследований: 1) ретропневмоперитонеума с томографией надпочечников; 2) радионуклидного исследования надпочечников; 3) компьютерной томографии; 4) селективной флебографии надпочечников. Особенно сложно выявить феохромоцитому вненадпочечниковой локализации. При наличии клинической картины заболевания и отсутствии опухоли надпочечников (по данным ретропневмоперитонеума с томографией) необходимо произвести грудную и брюшную аортографию с последующим тщательным анализом аортограмм. Из дополнительных методов для постановки диагноза феохромоцито-мы до проведения указанных инструментальных методов производят следующие лабораторные исследования: 1) определение суточной экскреции с мочой катехоламинов и вани- 2) раздельное исследование экскреции адреналина и норадреналина 3) гистаминовый (провоцирующий) и регитиновый (купирующий) Из дополнительных методов исследования при подозрении на болезнь и синдром Иценко — Кушинга производят: 1) определение в суточной моче содержания 17-кетостероидов и 17- 2) исследование суточного ритма секреции 17- и 11-оксикортикосте- 3) обзорный снимок турецкого седла и его компьютерную томогра 4) все описанные ранее инструментальные методы исследования над Постановкой диагноза эндокринного заболевания заканчивается диагностический поиск. Гемодинамические гипертензии.Гемодинамичес-кие АГ обусловлены поражением сердца и крупных сосудов и подразделяются на: 1) систолические гипертензии при атеросклерозе, брадикардии, аор 2) регионарные гипертензии при коарктации аорты; 3) гиперкинетический циркуляторный синдром при артериовенозных 4) ишемические застойные гипертензии при сердечной недостаточнос Все гемодинамические АГ связаны непосредственно с заболеваниями сердца и крупных сосудов, изменяющими условия системного кровотока, и способствуют подъему АД. Характерно изолированное или преимущественное повышение систолического АД. На I этапе диагностического поиска получают сведения: а) о времени возникновения повышения АД, его характере и субъективных ощущениях; б) о различных проявлениях атеросклероза у лиц пожилого возраста и степени их выраженности (перемежающаяся хромота, резкое снижение памяти и т.д.); в) о заболеваниях сердца и крупных сосудов, с которыми можно связать повышение АД; г) о проявлениях застойной сердечной недостаточности; д) о характере и эффективности лекарственной терапии. Возникновение АГ на фоне существующих заболеваний и прогресси-рование ее в связи с ухудшением течения основного заболевания обычно свидетельствует о симптоматическом характере гипертензии (АГ — симптом основного заболевания). На II этапе диагностического поиска выявляют: 1) уровень повышения АД, его характер; 2) заболевания и состояния, которыми определяется повышение АД; 3) симптомы, обусловленные АГ. У большинства пожилых больных АД не отличается стабильностью, возможны беспричинные подъемы и внезапные понижения его. АГ характеризуется повышением систолического давления при нормальном, а иногда и пониженном диастолическом — так называемая атеросклеротическая гипертензия или возрастная (склеротическая) у пожилых (без явных клинических проявлений атеросклероза). Выявление признаков атеросклероза периферических артерий (снижение пульсации на артериях нижних конечностей, похолодание их и т.д.) делает диагноз атеросклеротической АГ более вероятным. При аускультации сердца можно обнаружить интенсивный систолический шум на аорте, акцент II тона во втором межреберье справа, что свидетельствует об атеросклерозе аорты (иногда выявляется атеросклеротический порок сердца). Присоединение к уже существующей систолической АГ довольно стойкого повышения диастолического давления может свидетельствовать о развитии атеросклероза почечных артерий (систолический шум над брюшной аортой у пупка прослушивается не всегда). Может быть выявлено резкое повышение АД на руках и снижение его на ногах. Сочетание такой АГ с усиленной пульсацией межреберных артерий (при осмотре и пальпации), ослаблением пульсации периферических артерий нижних конечностей, запаздыванием пульсовой волны на бедренных артериях позволяет с достоверностью заподозрить коарктацию аорты. Выявляют грубый систолический шум у основания сердца, выслушиваемый над грудным отделом аорты спереди и сзади (в межлопаточной области), шум иррадиирует по ходу крупных сосудов (сонных, подключичных). Характерная аускультативная картина позволяет на II этапе с уверенностью поставить диагноз коарктации аорты. При физикальном исследовании могут быть выявлены признаки недостаточности аортального клапана, незаращения артериального протока, проявления застойной сердечной недостаточности. Все эти состояния могут приводить к АГ. На III этапе диагностического поиска можно поставить окончательный диагноз. Обнаруживаемое при исследовании липидного спектра крови повышение уровня холестерина (чаще а-холестерина), триглицеридов, р*-ли-попротеидов наблюдается при атеросклерозе. При офтальмоскопии могут быть выявлены изменения сосудов глазного дна, развивающиеся при атеросклерозе мозговых сосудов. Снижение пульсации сосудов нижних конечностей, иногда сонных артерий и изменение формы кривых на рео-грамме подтверждает атеросклеротическое поражение сосудов. На III этапе диагностического поиска обнаруживаются характерные электрокардиографические, рентгенологические и эхокардиографические признаки порока сердца (см. «Пороки сердца»). Больным с коарктацией аорты ангиография обычно производится для уточнения локализации и протяженности пораженного участка (перед операцией). Если имеются противопоказания к оперативному лечению, то для постановки диагноза достаточно данных физикального исследования. Центрогенные гипертензии.Центрогенные АГ обусловлены органическими поражениями нервной системы. На I этапе диагностического поиска выявляют характерные жалобы на пароксизмальное повышение АД, сопровождающееся тяжелыми головными болями, головокружениями и различными вегетативными проявлениями, иногда эпилептиформным синдромом. В анамнезе — указания на перенесенные травмы, сотрясение мозга, возможно, арахноидит или энцефалит. Сочетание характерных жалоб с соответствующим анамнезом делает вероятным предположение о нейрогенном генезе АГ. На II этапе диагностического поиска важно получить сведения, позволяющие высказать предположение об органических поражениях ЦНС. В начальной стадии болезни таких данных может не быть. При длительном течении болезни можно выявить особенности поведения, нарушения двигательной и чувствительной сферы, патологию со стороны отдельных черепных нервов. Сложно поставить правильный диагноз у лиц пожилого возраста, когда все особенности поведения объясняют развитием церебрального атеросклероза. На III этапе получают наиболее важные для диагностики сведения. Необходимость в проведении дополнительных методов исследования возникает при соответствующих изменениях глазного дна («застойные соски») и сужении полей зрения. Главной задачей IIIэтапа является четкий ответ на вопрос о том, есть у больного опухоль мозга или ее нет, так как только своевременная диагностика позволяет провести оперативное лечение. Больному, помимо рентгенографии черепа (информативность которой значима только при больших опухолях мозга), производят электроэнцефалографию, реоэнцефалографию, ультразвуковое сканирование и компьютерную томографию черепа. Диагностика.Выявление симптоматических гипертензий базируется на четком и точном диагнозе заболеваний, сопровождающихся повышением АД, и на исключении других форм СГ. Симптоматическая гипертензия может быть ведущим признаком основной болезни, и тогда она фигурирует в диагнозе: например, реноваску-лярная гипертензия. Если АГ является одним из многих проявлений заболевания и не выступает главным симптомом, то в диагнозе может не упоминаться, например при диффузном токсическом зобе, болезни или синдроме Иценко—Кушинга. Лечение I.Этиологическое лечение. При выявлении АГ, обусловленной пато При аденоме гипофиза используют методы активного воздействия с помощью рентгено- и радиотерапии, лечения лазером, в ряде случаев производят операции. Лекарственная терапия основного заболевания (узелкового периарте-риита, эритремии, застойной сердечной недостаточности, инфекции мочевых путей и т.д.) дает положительный эффект и в отношении АГ. II. Лекарственная гипотензивная терапия. В подавляющем боль Больным стойкой АГ при поражении почек широко назначают мочегонные средства [дихлотиазид (гипотиазид), фуросемид, триамтерен, или триампур композитум] в сочетании с ингибиторами АПФ. При отсутствии должного гипотензивного эффекта дополнительно назначают р-адреноблокаторы и периферические вазодилататоры. Комбинированная терапия с применением различных групп лекарственных средств показана при стабильной, особенно диастолической, АГ любого генеза. Особенно тщательно необходимо учитывать противопоказания к использованию лекарственных средств и возможные побочные эффекты. В пожилом возрасте не рекомендуется быстро снижать АД при длительной стабильной АГ, так как может ухудшиться коронарное, церебральное и почечное кровообращение. Для нормализации тонуса мозговых сосудов и улучшения регуляции нервных процессов можно применять малые дозы кофеина и кордиамина, особенно в утренние часы, когда АД невысокое. Прогноз.Прогноз СГ зависит от течения и исхода заболевания, проявлением которого является СГ. Профилактика.Профилактика СГ состоит в профилактике развития основного заболевания и его своевременном лечении. ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА Ишемическая болезнь сердца (ИБС) — острый или хронический патологический процесс в миокарде, обусловленный неадекватным его кровоснабжением вследствие атеросклероза коронарных артерий, корона-роспазма неизмененных артерий либо их сочетанием. Классификация.В 1979 г. Комитетом экспертов ВОЗ по стандартной клинической терминологии была разработана классификация ИБС, не нашедшая, однако, повсеместного распространения в нашей стране. В настоящее время ведется работа по созданию новой классификации. Основными формами ИБС считаются острый инфаркт миокарда, стенокардия, постинфарктный и диффузный кардиосклероз. Острый инфаркт миокарда относится к острым формам ИБС, стенокардия (определенные формы), а также постинфарктный и диффузный кардиосклероз — к хроническим ее формам. Главным этиологическим фактором ИБС является атеросклероз коронарных артерий. Факторы, предрасполагающие к его развитию, следует рассматривать как факторы риска ИБС. Наиболее важными среди них являются: 1) гиперлипидемия; 2) артериальная гипертензия; 3) курение; 4) гиподинамия (физическая детренированность); 5) избыточная масса тела и высококалорийное питание; 6) сахарный диабет; 7) генетическая предрасположенность. ИНФАРКТ МИОКАРДА Инфаркт миокарда (ИМ) — острое заболевание, обусловленное возникновением одного или нескольких очагов ишемического некроза в сердечной мышце в связи с абсолютной или относительной недостаточностью коронарного кровотока. У мужчин ИМ встречается чаще, чем у женщин, особенно в молодых возрастных группах. В группе больных в возрасте от 21 года до 50 лет это соотношение равняется 5:1, от 51 года до 60 лет — 2:1. В более поздние возрастные периоды эта разница исчезает за счет увеличения числа инфарктов у женщин. В последнее время значительно увеличилась заболеваемость ИМ лиц молодого возраста (мужчин до 40 лет). Классификация.ИМ подразделяется с учетом величины и локализации некроза, характера течения заболевания. • В зависимости от величины некроза различают крупноочаговый и мелкоочаговый инфаркт миокарда. С учетом распространенности некроза в глубь мышцы сердца в настоящее время выделяют следующие формы ИМ: ♦ трансмуральный (включает как QS-, так и Q-инфаркт миокарда, ♦ ИМ без зубца Q (изменения касаются лишь сегмента ST и зубца Г; • По локализации выделяют передний, верхушечный, боковой, сеп- Указанные локализации относятся к левому желудочку как наиболее часто страдающему при ИМ. Инфаркт правого желудочка развивается крайне редко. • В зависимости от характера течения выделяют ИМ с затяжным те Затяжное течение характеризуется длительным (от нескольких дней до недели и более) периодом следующих один за другим болевых приступов, замедленными процессами репарации (затянувшимся обратным развитием изменений на ЭКГ и резорбционно-некротического синдрома). Рецидивирующий ИМ — вариант болезни, при котором новые участки некроза возникают в сроки от 72 ч до 4 нед после развития ИМ, т.е. до окончания основных процессов рубцевания (появление новых очагов некроза в течение первых 72 ч — расширение зоны ИМ, а не рецидив его). Развитие повторного ИМ не связано с первичным некрозом миокарда. Обычно повторный ИМ возникает в бассейнах других коронарных артерий в сроки, как правило, превышающие 28 дней от начала предыдущего инфаркта. Эти сроки установлены Международной классификацией болезней X пересмотра (ранее этот срок был указан как 8 нед). Этиология.Основной причиной ИМ является атеросклероз коронарных артерий, осложненный тромбозом или кровоизлиянием в атероскле-ротическую бляшку (у умерших от ИМ атеросклероз коронарных артерий обнаруживается в 90 — 95 % случаев). В последнее время существенное значение в возникновении ИМ придается функциональным нарушениям, приводящим к спазму коронарных артерий (не всегда патологически измененных) и острому несоответствию объема коронарного кровотока потребностям миокарда в кислороде и питательных веществах. Редко причинами ИМ бывают эмболии коронарных артерий, тромбоз их при воспалительных поражениях (тромбангиит, ревматический корона-рит и т.д.), сдавление устья коронарных артерий расслаивающей аневризмой аорты и пр. Они приводят к развитию ИМ в 1 % случаев и не относятся к проявлениям ИБС. Факторами, способствующими возникновению ИМ, являются: 1) недостаточность коллатеральных связей между коронарными сосу 2) усиление тромбообразующих свойств крови; 3) повышение потребности миокарда в кислороде; 4) нарушение микроциркуляции в миокарде. Чаще всего ИМ локализуется в передней стенке левого желудочка, т.е. в бассейне кровоснабжения наиболее часто поражаемой атеросклеро-
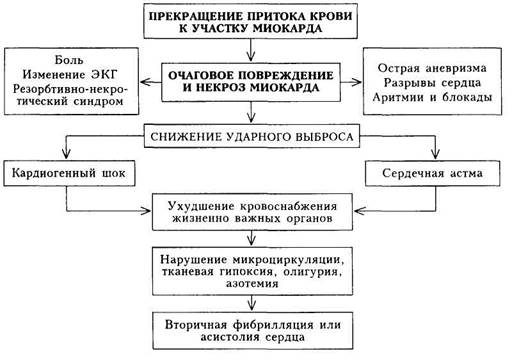
зом передней нисходящей ветви левой коронарной артерии. Второе место по частоте занимает ИМ задней стенки левого желудочка; ИМ межжелудочковой перегородки составляет 25 % всех поражений. Патогенез.В патогенезе ИМ ведущая роль принадлежит прекращению притока крови к участку сердечной мышцы, что приводит к повреждению миокарда, его некрозу, ухудшению жизнедеятельности периин-фарктной зоны (схема 13). Некроз миокарда проявляется резорбционно-некротическим синдромом (данные лабораторных исследований, повышение температуры тела) подтверждается данными ЭКГ. Он вызывает длительный болевой синдром, может проявляться развитием аритмий и блокад сердца, а трансму-ральный некроз — разрывами сердца или острой аневризмой. Некроз миокарда, нарушение состояния периинфарктной зоны способствуют снижению ударного и минутного объемов сердца. Клинически это проявляется развитием острой левожелудочковой недостаточности — отеком легких и(или) кардиогенным шоком. Последний сопровождается резким снижением кровоснабжения жизненно важных органов, что приводит к нарушению микроциркуляции, тканевой гипоксии и накоплению продуктов обмена. Метаболические нарушения в миокарде служат причиной тяжелых нарушений ритма сердца, нередко заканчивающихся фибрилляцией желудочков. Возникающее при кардиогенном шоке снижение коронарного кровотока еще больше способствует снижению насосной функции сердца и усу- губляет течение кардиогенного шока, отека легких — главных причин смерти при ИМ. Клиническая картина.Проявления ИМ определяются вариантом начала болезни, периодом течения и развитием тех или иных осложнений. В течении ИМ выделяют ряд периодов. Острейший период (I) — время между возникновением ишемии участка миокарда (так называемая ишемическая стадия) и появлением признаков его некроза (от 30 мин до 2 ч). Острый период (II) — образуется участок некроза и миомаляции (продолжительность 10 дней; при затяжном и рецидивирующем течении дольше). Подострый период (III) — завершаются начальные процессы организации рубца (с 10-го дня до конца 4 — 8-й недели от начала заболевания). Постинфарктный (послеинфарктный) период (IV) характеризуется увеличением плотности рубца и максимально возможной адаптацией миокарда к новым условиям функционирования сердечно-сосудистой системы (продолжается 2 — 6 мес с момента образования рубца). Выделяют продромальный период («предынфарктное состояние»), который характеризуется: а) стенокардией, впервые возникшей в течение ближайших 4 нед; б) увеличением частоты и усугублением тяжести приступов у больного со стабильной до того стенокардией; в) появлением стенокардии покоя у больного со стенокардией напряжения; г) так называемой вариантной стенокардией (см. «Хроническая ишемическая болезнь сердца»). Этот период может продолжаться от нескольких часов до месяца. Типичная, или ангинозная, форма начала ИМ отличается интенсивным болевым синдромом с локализацией боли за грудиной, в области сердца, часто иррадиирующей в левую руку, плечо, лопатку, челюсть и т.д. Боль длительная, не купируется нитроглицерином, сопровождается холодным потом, страхом смерти. Помимо типичной формы начала болезни, выделяют ряд других вариантов (форм): 1) астматический — начало болезни проявляется одышкой или уду 2) гастралгический — боли в животе, чаще в подложечной области, 3) аритмический — манифестация заболевания нарушениями ритма, 4) церебральный — основными проявлениями служат неврологичес 5) с атипичной локализацией боли (боль появляется в позвоночнике, 6) «бессимптомный» — симптомы общего недомогания, немотивиро Астматический и гастралгический варианты встречаются наиболее часто. Осложнения. В острейший период ИМ часто успевают развиться тяжелые нарушения сердечного ритма и острая недостаточность кровообращения, которые могут привести к летальному исходу (в этот период больному еще не оказывается интенсивная врачебная помощь). В острый период возникают осложнения, большинство которых также может служить причиной смерти больных: 1) нарушения ритма и проводимости (пароксизмальная тахикардия, 2) шок (рефлекторный, кардиогенный и аритмический); 3) сердечная астма, отек легких (проявление острой левожелудочко- 4) острая аневризма сердца; 5) разрывы сердца (в том числе перфорация межжелудочковой пере 6) тромбоэмболические осложнения (в большом и малом круге крово 7) парез желудка и кишечника, эрозивный гастрит с желудочным Подострый период протекает более благоприятно, но и в его течении возможны осложнения: 1) тромбоэндокардит с тромбоэмболическим синдромом (чаще эмбо 2) пневмония; 3) постинфарктный синдром — синдром Дресслера, синдром перед 4) психические изменения (чаще неврозоподобные симптомы); 5) хроническая левожелудочковая сердечная недостаточность; 6) начало формирования хронической аневризмы сердца; 7) правожелудочковая недостаточность развивается редко. При ее на В постинфарктном периоде заканчивается формирование хронической аневризмы, могут оставаться проявления синдрома Дресслера и симптомы хронической сердечной недостаточности. Вновь могут возникнуть нарушения ритма сердца. В целом для этого периода развитие осложнений нехарактерно. На I этапе диагностического поиска на основании клинической картины, характера ее развития, с учетом предшествующего анамнеза, возраста и пола больного можно: а) заподозрить развитие ИМ; 6) высказать предположения о клиническом варианте болезни; в) получить сведения о тех или иных осложнениях. При наличии длительного приступа нестерпимых болей за грудиной и в области сердца с характерной иррадиацией, не купирующихся нитроглицерином, следует прежде всего предположить ИМ, особенно у мужчин старше 40 лет. Надо помнить, что такая симптоматика иногда мо- жет быть обусловлена и другими причинами (неврит, плеврит, миозит и др.). Остро возникший приступ удушья, особенно у лиц пожилого возраста, прежде всего наводит на мысль об астматическом варианте ИМ. Однако острая левожелудочковая недостаточность может быть проявлением иной болезни (аортальный или митральный порок сердца, гипертоническая болезнь). Сердечная астма и отек легких при соответствующей клинической картине ИМ могут быть не вариантом его начала, а осложнением. Наличие резких болей в эпигастральной области, особенно у больных с хронической ИБС, позволяет заподозрить гастралгический вариант ИМ. Подобная клиническая картина может быть проявлением других заболеваний (обострение язвенной болезни, гастрита, холецистита, острого панкреатита; пищевое отравление, особенно при наличии симптомов желудочной диспепсии). Жалобы больного на приступы сердцебиений или резкого урежения ритма, появление аритмий, обмороков могут указывать на начало ИМ или его осложнений. Кроме этого, нарушения ритма могут появиться и вне связи с ИМ и быть проявлением НЦД, миокардитического кардиосклероза, хронической ИБС и др. Интенсивный болевой синдром с атипичной локализацией реже напоминает ИМ, но не исключает его, в связи с чем дальнейшее обследование больного обязательно. Внезапное немотивированное развитие кардиогенного шока, когда больной заторможен, вял, сознание его спутано, также должно вызвать у врача подозрение на ИМ. Все сведения, полученные на I этапе, должны оцениваться с учетом данных физикального и лабораторно-инструментального обследования. Иногда на этом этапе диагностического поиска можно не получить никакой информации, позволяющей поставить диагноз ИМ. Диагностический поиск ИМ, особенно у лиц пожилого и старческого возраста, нельзя прекращать. На II этапе диагностического поиска можно получить сведения: а) косвенно указывающие на развитие ИМ (прямых признаков не существует); б) позволяющие выявить осложнения. При соответствующем анамнезе такие симптомы, как повышение температуры тела, тахикардия, артериальная гипотензия, особенно развившаяся на фоне предшествующей гипертензии, глухость тонов сердца и кратковременно выслушиваемый шум трения перикарда, позволяют высказаться в пользу диагноза ИМ. Однако сами по себе эти симптомы непа-тогномоничны для ИМ и могут встречаться при ряде заболеваний (ревматизм, миокардит, перикардит и т.д.). Физикальное исследование помогает выявить симптомы возможных осложнений. Для кардиогенного шока характерны: холодная кожа серо-бледного цвета, покрытая липким потом (нарушение периферической циркуляции); олигоанурия (уменьшение мочеобразования); нитевидный пульс; уменьшение пульсового давления (менее 20 — 30 мм рт.ст.); снижение систолического давления (ниже 80 мм рт.ст.; непостоянный симптом). Могут наблюдаться симптомы острой левожелудочковой недостаточности: одышка, ортопноэ, влажные хрипы в легких. Тромбоэмболия легочной артерии проявляется одышкой, болями в груди, кровохарканьем, появлением цианоза. Увеличенная печень, периферические отеки — симптомы недостаточности кровообращения в большом круге. При физикальном обследовании представляется возможность обнаружить брадитахикардию, экстрасистолию, мерцательную аритмию, паро-ксизмальную тахикардию. Диагностическое значение всех указанных осложнений невелико, так как они встречаются и при других заболеваниях. Лишь в сочетании с анамнезом и данными III этапа они значимы при постановке диагноза ИМ. Большое диагностическое значение приобретает выявление острой аневризмы (патологическая пульсация в прекардиальной области), разрыва межжелудочковой перегородки (интенсивный систолический шум в нижней трети грудины с симптомами быстро нарастающей недостаточности кровообращения в малом и большом круге), разрыва или отрыва сосо-чковой мышцы (дующий систолический шум на верхушке сердца, иногда определяемый пальпаторно, в сочетании с нарастающим застоем в малом круге кровообращения). III этап диагностического поиска позволяет: а) поставить окончательный диагноз ИМ; б) уточнить его локализацию и распространенность (степень поражения миокарда); в) подтвердить или выявить нарушения ритма и проводимости; г) выявить новые осложнения (аневризма сердца, очаговое поражение почек при тромбоэмболии). Поставить окончательный диагноз ИМ можно на основании сочетания признаков резорбционно-некротического синдрома и данных ЭКГ. Резорбционно-некротический синдром выявляется по результатам общеклинического и биохимического исследований крови: лейкоцитоз со сдвигом лейкоцитарной формулы влево и анэозинофилия (не всегда) с первых часов заболевания; увеличение СОЭ с 3 —5-го дня; повышение в крови активности ферментов — креатинфосфокиназы (КФК) и ее МВ-фракции (с первых часов, сохраняющееся 2 — 3 дня), аминотрансфераз (особенно аспарагиновой и в меньшей степени аланиновой с конца первых суток, нормализующееся к 3 —5-му дню), ЛДГ — лактатдегидрогеназы (общей) и ее первого и второго изоферментов, которое может держаться 10—14 дней. В настоящее время при острой коронарной патологии наряду с прочно вошедшими в клиническую практику лабораторными методами, такими как исследование уровня КФК, ЛДГ-1, КФК-МБ, широко используют новые маркеры — тропонин Т, тропонин И и миоглобин. Тропонин является белковым комплексом, регулирующим мышечное сокращение, и состоит из трех субъединиц — тропонин Т (ТнТ), тропонин Ц (ТнЦ) и тропонин И (ТнИ). В начале 90-х годов были разработаны иммунологические методы, позволяющие с помощью моноклональных антител различать тропонины Т и И кардиомиоцитов и других поперечнополосатых мышечных волокон. Считается, что ТнИ и ТнТ являются наиболее чувствительными и специфичными маркерами некроза сердечной мышцы. Их уровень повышается в крови уже через 2 — 3 ч после инфаркта миокарда, увеличивается в 300 — 400 раз по сравнению с нормой и сохраняется повышенным в течение 10—14 дней. В последнее время появились данные о том, что уровень ТнТ может повышаться при ХПН и некоторых других патологических состояниях, в связи с чем большее предпочтение отдается ТнИ. Миоглобин — хромопротеид, сходный по строению с гемоглобином, — пигментный белок мышечной ткани, обеспечивающий депонирование в ней кислорода, что особенно важно для сердечной мышцы. У здоровых людей уровень миоглобина в крови, определяемый радиоиммунным методом, не превышает 80 мкг/л, а с мочой за сутки выделяется 0,4 — 4 мкг. При травмировании и ишемии мышц миоглобин, обладая малой молекулярной массой, быстро выделяется в кровь, а затем поступает в мочу. При ИМ содержание миоглобина в крови у большинства больных превышает 200 мкг/л через 4 ч после ангинозного приступа, а через б ч его уровень повышается у 100 % больных с впервые возникшим ИМ. Определение гипермиоглобинемии — наиболее достоверный тест для исключения острого ИМ в ранние сроки. Электрокардиография является методом, который позволяет уточнить диагноз ИМ, его локализацию, глубину и обширность поражения, фазу течения; подтвердить или выявить нарушения ритма и проводимости; высказать предположение о развитии аневризмы сердца. В ишемическую стадию отмечаются подъем сегмента ST в так называемых «прямых» отведениях (в этих отведениях в последующем будет формироваться патологический зубец Q) и реципрокное снижение ST в отведениях, в которых изменений комплекса QRS не будет. В острую фазу в «прямых» отведениях при трансмуральном ИМ резко снижается (или полностью исчезает) зубец R и формируется комплекс QS. При меньшей глубине поражения некрозом стенки миокарда в «прямых» отведениях появляется патологический зубец Q (равный по амплитуде '/3 зубца R или более, длительностью 0,04 с и более). Последующая эволюция ЭКГ сводится к возвращению сегмента ST к изоэлектрической линии и формированию в «прямых» отведениях отрицательного («коронарного») зубца Т. При нетрансмуральном инфаркте изменения ограничиваются небольшим смещением сегмента ST вверх или вниз и инверсией зубца Т. Для инфаркта миокарда передней стенки (включая область верхушки) характерны изменения ЭКГ в отведениях I, II, aVL и Уз,4; для инфаркта нижней стенки — в отведениях II, III и aVF; для инфаркта боковой стенки — в отведениях I, aVL и У$,6, при поражениях области перегородки выявляют изменения в отведениях Vi^co- ЭКГ не является информативной в случае предшествовавшей блокады левой ножки пучка Гиса и при инфаркте правого желудочка. На ЭКГ выявляются самые разнообразные нарушения ритма, встречающиеся при ИМ. По ЭКГ впервые узнают о нарушениях атриовентрикулярной проводимости и проводимости по ножкам пучка Гиса, определяют характер блокады и ее степень. Признаком, позволяющим предположить аневризму, является так называемая застывшая ЭКГ — сохранение подъема сегмента ST в сочетании с комплексом QS в «прямых» отведениях, при этом может отмечаться «коронарный» зубец Т. Ультразвуковой метод исследования позволяет выявить участок гипокинезии или акинезии, соответствующий зоне поражения, а также состояние сосочковых мышц и межжелудочковой перегородки, которые также могут поражаться при инфаркте миокарда. При рентгеноскопии органов грудной клетки можно выявить анев-ризматическое выпячивание и участок парадоксальной пульсации. Данные инструментальных исследований, проводимых в общепринятом порядке, позволяют выявить атеросклеротическое поражение аорты (при рентгенологическом исследовании органов грудной клетки) и сосудов нижних конечностей (по данным реографии). Эти симптомы являются косвенным доводом наличия атеросклеротического поражения коронарных артерий при ИМ. На III этапе диагностического поиска могут быть впервые получены данные, свидетельствующие о тромбоэмболии мелких сосудов почки (гематурия, невысокая протеинурия). В подавляющем большинстве случаев диагностический поиск на этом заканчивается и формулируется развернутый клинический диагноз. Иногда прибегают к специальным методам диагностики. 1. Визуализация ИМ с помощью радиоактивных изотопов. Этот Пирофосфат, меченный технецием, начинает накапливаться в зоне некроза спустя 12 ч от начала заболевания, и очаг «свечения» определяется до 2 нед, а при обширных поражениях — 2 — 3 мес. Реже используют 201Т1, который накапливается в хорошо кровоснаб-жаемых участках миокарда и не поступает в зону некроза. 2. Селективная коронарография применяется для решения вопроса о Диагностика.Диагноз ИМ с достоверностью может быть поставлен с учетом трех основных синдромов. • Характерный болевой синдром или его эквиваленты в сочетании с • Изменения на ЭКГ: признаки ИМ с характерной последующей ди • Признаки резорбционно-некротического синдрома: повышение тем Формулировка развернутого клинического диагноза ИМдолжна отражать: характер течения (рецидивирующий, с затяжным течением, повторный); глубину некроза; локализацию ИМ; дату возникновения ИМ; осложнения; фоновые заболевания — атеросклероз коронарных артерий и других сосудов (отсутствие атеросклероза коронарных артерий отмечается при соответствующих данных коронарографии); стадию гипертонической болезни (при ее наличии); стадию недостаточности кровообращения (при ее наличии). Лечение.Лечебные мероприятия при ИМ складываются из системы организационных и терапевтических мероприятий. Организационные мероприятия включают: 1) оказание врачами специализированной бригады скорой помощи «на месте» высококвалифици- 8 - 540 "J рованного лечения; 2) возможно раннюю госпитализацию больного; 3) наблюдение за больным в острый период в палате интенсивной терапии; 4) систему восстановительного лечения (реабилитация). Терапевтические мероприятия проводятся с учетом стадии ИМ, выраженности и характера осложнений. Лекарственная терапия (режим, диета, ЛФК) назначается индивидуально в зависимости от состояния и тяжести течения ИМ. Основными направлениями лекарственной терапии острого периода ИМ являются: • купирование боли; • ранний тромболизис; • антикоагулянты и ацетилсалициловая кислота; • разгрузка миокарда; • предупреждение опасных аритмий сердца; • лечение осложнений. ♦ Купирование болевого синдрома наиболее эффективно осущест Обезболивающий эффект оказывают гепарин и тромболитические средства, вводимые в это же время. ♦ Тромболитическую терапию, направленную на реперфузию зоны В качестве тромболитических средств в настоящее время применяют стрептокиназу, урокиназу или тканевый активатор плазминогена. Внутривенную инфузию стрептокиназы осуществляют в дозе 1 500 000 ME в течение 30 — 40 мин. Препарат разводят в изотоническом растворе хлорида натрия до объема 100 мл; инфузию осуществляют в два этапа: сначала первые 250 000 ME (50 мл) вводят внутривенно капельно в течение 10 мин, а затем после 15-минутного перерыва вводят остальные 1 250 000 ME (50 мл) также в течение 10 мин. Непосредственно перед началом инфузии стрептокиназы и сразу же после ее окончания следует ввести внутривенно струйно по 100 мг гидрокортизона или 60 — 90 мг преднизолона. При лечении стрептокиназой гепарин или не назначают, или вводят подкожно по 12 500 ЕД 2 раза в сутки. При наличии противопоказаний к применению тромболитической терапии в первые часы острого ИМ иногда для ликвидации окклюзии коронарной артерии в специализированных условиях (в лаборатории по коро- нарной катетеризации) проводят чрескожную транслюминальную коронарную ангиопластику (ЧТКА). К этой процедуре прибегают и при отсутствии эффекта от тромболитической терапии. ♦ Ацетилсалициловую кислоту в качестве антиагреганта назначают При невозможности проведения тромболитической терапии больному проводят антитромботическую (антикоагулянтную) терапию гепарином. Гепарин вводят внутривенно в течение 24 —48 ч в средней дозе 1000 ЕД/ч под контролем АЧТВ. Далее гепарин вводят в течение 3 — 4 сут (при затяжном течении, тромбоэмболиях — до 7 сут) каждые 6 ч под контролем свертываемости крови. Антикоагулянтная терапия осуществляется для предупреждения: а) прогрессирования тромбоза в коронарных артериях; 6) внутрисердеч-ного тромбоза; в) системной эмболии; г) развития венозного тромбоза. Проведение антикоагулянтной и тромболитической терапии рассчитано и на улучшение микроциркуляции («ограничение» очага поражения) в периинфарктной зоне, от состояния которой во многом зависит течение инфаркта в первые сутки. ♦ При ИМ с Q-зубцом больным показано раннее (в первые сутки) на Для разгрузки миокарда, помимо нитроглицерина, назначают р-адре-ноблокаторы и ингибиторы АПФ. (З-Адреноблокаторы назначают внутрь в первые сутки ИМ в случае развития тахикардии (в отсутствие сердечной недостаточности), при относительно повышенном АД или для купирования болевого синдрома, когда неэффективны наркотические (опиоидные) анальгетики. На 2 —4-й день заболевания добавляют ингибиторы АПФ (капто-прил, эналаприл, рамиприл, периндоприл). Установлено, что они оказываются особенно эффективными, если у больных с острым ИМ имелось снижение фракции выброса или были признаки сердечной недостаточности в ранней фазе заболевания. Назначение ингибиторов АПФ показано всем больным, перенесшим ранее ИМ. В лечении больных острым ИМ без зубца Q применяется, как правило, терапия гепарином, нитратами и (З-адреноблокаторами. ♦ Комплексная ранняя лекарственная терапия острого ИМ способст ♦ Лечение осложнений определяется их характером и выраженнос Лечение кардиогенного шока проводят с учетом формы шока и гемодинамических параметров. А. Рефлекторная форма шока. При данной форме кардиогенного шока применяют: а) обезболивание; б) прессорные препараты; в) плазмо-замещающие растворы. При сохранении артериальной гипотензии и купировании болевого синдрома внутривенно вводят 0,5—1,0 мл 1 % раствора мезатона; при недостаточном эффекте производят внутривенную инфузию раствора допа-мина. С целью увеличения венозного притока к сердцу иногда внутривенно вводят плазмозамещающие растворы, чаще реополиглюкин (низкомолекулярный декстран). Б. Истинный кардиогенный шок. Данное осложнение ИМ в 50 % случаев заканчивается летально. Относительно оптимистические перспективы открываются при своевременном восстановлении коронарного кровотока с помощью тромболитиков или так называемых механических методов лечения (транслюминальная ангиопластика или аортокоронарное шунтирование). Развитие его зависит в конечном итоге от размеров зоны поражения. Среди методов лечения наиболее эффективны следующие: 1) применение периферических вазодилататоров в сочетании с допа- 2) нормализация кислотно-основного состояния; 3) использование низкомолекулярного декстрана (реополиглюкин). Периферические вазодилататоры обеспечивают гемодинамическую разгрузку миокарда (уменьшают работу сердца, снижают потребность миокарда в кислороде), способствуют улучшению коронарной циркуляции. П
Поиск по сайту: |