 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Тема : Способы выражения состава растворов. Приготовление растворов
Теоретический материал к занятию:
Эквивалент – это реальная или условная частица вещества Х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции одному электрону.
Массовая доля растворенного вещества Х – растворенное вещество
Молярная концентрация,
Молярная концентрация эквивалента
Фактор эквивалентности,
Молярная масса эквивалента,
Плотность раствор,
Моляльная концентрация,
Формулы перехода от одних способов выражения состава раствора к другим
Задача. Какой объем соляной кислоты (ρ=1,070 г/мл) и воды необходим для приготовления раствора HCl объемом 200 мл и молярной концентрацией 0,1 моль/л для кислотно-основного титрования натрия тетрабората.
2. Массу исходного раствора HCl можно рассчитать по формуле :
m (p-p HCl) = m (HCl) / V (HCl) (m (HCl) и V (HCl) – неизвестны)
3. Массовую долю ω можно найти в справочнике, зная плотность ρ исходного раствора HCl. Массу HCl можно рассчитать зная молярную массу вещества и количество вещества
m (HCl) = M (HCl) · n (HCl) (n (HCl) – неизвестно)
4. Количество вещества HCl можно рассчитать зная объем раствора и его концентрацию n (HCl) = V (p-p) · C(HCl) (обе величины даны в условии задачи)
4.1 n (HCl) = 0,2 л · 0,1 моль/л = 0,02 моль
4.2 m (HCl) = 36,5 г/моль · 0,02 моль = 0,73 г
4.3 ω (%) = 14% или ω (в долях) = 0,14 (по таблице №14)
4.4 m (p-p HCl) = 0,73 г / 0,14 = 5,2 г
4.5 V (р-р HCl) = 5,2 г / 1,07 г/мл = 5мл
4.6 V(H2О) = 200 мл - 5 мл = 195 мл Тема: Способы выражения состава растворов. Приготовление растворов Решение задач 1. Можно ли использовать для инъекций раствор хлорида натрия, с концентрацией 0,154 моль/л (плотность раствора 1,001 г/л.)? _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Рассчитайте молярную концентрацию раствора пероксида водорода с массовой долей вещества равной 3% (плотность раствора пероксида водорода 1,0058 г/л,.). _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Вычислите, какую массу раствора соли с массовой долей 10% следует взять для приготовления 100 г раствора той же соли с массовой долей, равной 6%. _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Смешали по 100 мл растворов KI и КВr с концентрациями 0,1 моль/л. Какова стала концентрация ионов калия и йодид-ионов? _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Поиск по сайту: |
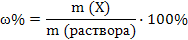
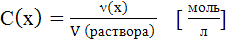





 (m (р-р HCl) – неизвестна)
(m (р-р HCl) – неизвестна)