 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Влияние бактериальных токсинов на активность аденилатциклазы (АДФ-рибозилирование G-белков)
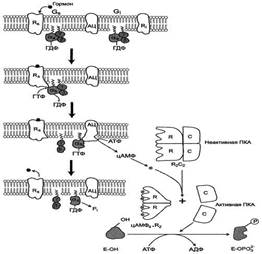
Для изучения функционирования G-белков аденилатциклазной системы были использованы экзогенные бактериальные яды - холерный и коклюшный токсины. Токсины в экспериментальных условиях повышают активность аденилатциклазы практически во всех клетках организма. Холерный токсин - олигомерный белок. Одна из субъединиц - фермент АДФ-рибозилтрансфераза; проникая в клетку, она катализирует присоединение АДФ-рибозы к ос8-субъединице комплекса [αs-ГТФ][АЦ] (этап активации аденилатциклазы). NAD++ [αiβγ-ГТФ][АЦ] → [АДФ-рибозил-αs ГТФ[АЦ] + никотинамид + Н+. АДФ-рибозилирование ингибирует проявление ГТФ-фосфатазной активности αs-субъединицы, не происходит дефосфорилирование ГТФ. Цикл функционирования Gs-белка останавливается на этапе активации фермента аденилатциклазы, отвечающего за образование цАМФ из АТФ. Фермент аденилатциклаза сохраняет повышенную активность в течение длительного времени. Субъединица коклюшного токсина, проникая в клетку, катализирует АДФ-рибозилирование α-субъединицы активированного Gs-белка NAD++ [αiβγ-ГТФ] -" [АДФ-рибозил- αiβγ-ГТФ] + никотинамид + Н+. Модифицированная α,-субъединица сохраняет высокое сродство к βγ-субъединицам, т.е. Gi-белок теряет способность диссоциировать на αi-ГТФ и βγ-субъединицы. Таким образом, ингибирующий сигнал (αi-ГТФ) не достигает аденилатциклазы, значит в этом случае возможна только её активация при связывании с αs-ГТФ. Действие коклюшного токсина на клетки тканей всегда приводит к повышению уровня цАМФ.
Гуанилатциклазная система: Довольно долгое время циклический гуанозинмонофосфат (цГМФ) рассматривался как антипод цАМФ. Ему приписывали функции, противоположные цАМФ. К настоящему времени получено много данных, что цГМФ принадлежит самостоятельная роль в регуляции функции клеток. В частности, в почках и кишечнике он контролирует ионный транспорт и обмен воды, в сердечной мышце служит сигналом релаксации и т.д. Известны четыре разные формы гуанилатциклазы, три из которых являются мембраносвязанными и одна, растворимая, открыта в цитозоле. Показано, что мембраносвязанные формы состоят из 3 участков: рецепторного, локализованного на внешней поверхности плазматической мембраны; внутримембранного доменаи каталитического компонента, одинакового у разных форм фермента. Гуанилатциклаза открыта во многих органах, что свидетельствует о широком ее участии в регуляции внутриклеточного метаболизма, опосредованном через цГМФ. Мембраносвязанный фермент активируется через соответствующие рецепторы короткими внеклеточными пептидами, в частности гормоном предсердным натрийуретическим пептидом (АНФ), термостабильным токсином грамотрицательных бактерий и др. АНФ, как известно, синтезируется в предсердии в ответ на увеличение объема крови, поступает с кровью в почки, активирует гуанилатциклазу (соответственно повышает уровень цГМФ), способствуя экскреции Na и воды. Гладкие мышечные клетки сосудов также содержат аналогичную рецептор-гуанилатциклазную систему, посредством которой связанный с рецептором АНФ оказывает сосудорасширяющее действие, способствуя снижению кровяного давления. В эпителиальных клетках кишечника активатором рецептор–гуанилатциклазной системы может служить бактериальный эндотоксин, который приводит к замедлению всасывания воды в кишечнике и развитию диареи. Б) цAMФ осуществляет функции вторичного внутриклеточного посредника в действии первичных посредников — например, ряда гормонов и нейромедиаторов. цAMФ опосредует биологическую функцию гормонов путем активации (инактивации) клеточных протеинкиназ (фосфатаз). Протеинкиназы, в свою очередь, фосфорилируют эффекторные белки и изменяют (увеличивают или уменьшают) их активность. При активации аденилатциклазы, катализирующей образование цAMФ из АТФ, или блокировании фосфодиэстеразы, осуществляющей деградацию этого цAMФ, концентрация цAMФ в клетке увеличивается. Таким образом, содержание цАМФ в клетке определяется соотношением активностей этих двух ферментов. Связь между гормоном или др. химическим сигналом (первый посредник) и цAMФ (второй посредник) осуществляет аденилатциклазный комплекс. Гормон, взаимодействуя с рецептором, активирует аденилатциклазу, которая образует цAMФ из АТФ. Концентрация цAMФ, образующегося в клетке, превышает концентрацию действующего на клетку гормона в 100 раз. В основе механизма действия цAMФ в тканях животных и человека лежит его взаимодействие с протеинкиназами, например, протеинкиназы А. Связывание цAMФ с регуляторной субъединицей протеинкиназы приводит к диссоциации фермента и активации его каталитической субъединицы, которая, освободившись от регуляторной субъединицы, способна фосфорилировать определённые белки (в том числе ферменты). Изменение свойств этих макромолекул путём фосфорилирования меняет и соответствующие функции клеток. цAMФ играет определённую роль в морфологии, подвижности, пигментации клеток, в кроветворении, клеточном иммунитете, вирусной инфекции и др. Циклический гуанозинмонофосфат это циклическая форма нуклеотида, образующаяся из гуанозинтрифосфата (GTP) ферментом гуанилатциклазой. цГМФ действует как вторичный посредник и его действие подобно цАМФ, в основном активируя внутриклеточные протеинкиназы в ответ на связывание с клеточной мембраной пептидных гормонов (для которых мембрана непроницаема) с внешней стороны клетки. Инозитолтрифосфат - это водорастворимый второй посредник, диффундирующий в цитозоль. Он действует в первую очередь путем высвобождения кальция (Ca) из эндоплазматического ретикулума. Например, он активирует кальция (Ca) -зависимую фосфокиназу, фосфорилирующую ферменты. Внутриклеточная система второго посредника ИФ3 также может управляться множеством внешних медиаторов и гормонов, в том числе ацетилхолином, серотонином, вазопрессином и тиреотропным гормоном; как и система цАМФ, она характеризуется разнообразными внутриклеточными эффектами. Возможно, эта система активируется и светом в зрительном рецепторе глаза, и играет центральную роль в фототрансдукции. Впервые в индивидуальном развитии организма рецептор системы ИФ3 активируется спермием, вследствие чего ИФ3 принимает участие в регуляторных реакциях, сопровождающих оплодотворение яйцеклетки. Липидная субъединица ДАГ также переносит сигнал, диффундируя в липидной фазе плазматической мембраны к расположенной на ее внутренней поверхности С-киназе, которая и активируется с участием фосфатидилсерина в качестве кофактора. Затем С-киназа запускает фосфорилирование белков, переводя их в активную форму. В передаче сигнала диацилглицерол используется как вторичный посредник липидной природы и является продуктом гидролиза фосфоинозитолдифосфата (PIP2) ферментом фосфолипазой С (PLC), связанным с мембраной, который в этой же реакции образует инозитолтрифосфат (IP3). Хотя инозитолтрифосфат перемещается в цитозоль, диацилглицерол остается связанным с плазматической мембраной ввиду ее гидрофобных свойств. Диацилглицерол является активатором протеинкиназы С (PKC). Образование диацилглицерола в мембране облегчает транслокацию протеинкиназы С из цитозоля в плазматическую мембрану. Протеинкиназа С является Са-кальмодулинзависимой, однако диацилглицерол повышает её сродство к Са-кальмодулину, вызывая активацию при более низкой концентрации ионов кальция в цитоплазме. Диацилглицерол является короткоживущим соединением, он может фосфорилироваться с образованием фосфатидной кислоты или расщепляться с образованием арахидоновой кислоты, необходимой для синтеза простагландинов. В) NO можно рассматривать как мессенджер 2 порядка, запускающего работу гуанилатциклазного каскадного механизма. Гуанилатциклаза может быть в мембране и в цитоплазме. Образуется NO под дейcтвием NO-синтазы из l-аргинина->l-цитрулин->NO. NO-синтаза – НАДФ зависимый фермент. Процесс происходит в присутствии О2. Активность NO-синтазы регулируется нейромедиаторами. Образовавшийся NO связывается с гемом, который является частью фермента гуанилатциклазы. При этом гуанилатциклаза начинает нарабатывать цГМФ из ЦТФ. цГМФ стимулирует протеинкиназу, фосфорилирующую соответствующие белки в клетке. Например, в гладких мышцах ими являются легкие цепи миозина, происходит расслабление гладкой мускулатуры. Т.О. главная мишень для NO – гуанилатциклаза. NO способен связываться с супероксиданионами, образуя пероксинитриты, которые распадаются на гидроксиланион NO2. И то, и другое – свободные радикалы. Это обеспечивает бактерицид. и противоопухолев. рец-р NO. В клетках почек под действием NO повышается уровень матричной РНК, кодирующей АМК последовательность ренина. Т1/2 – короткий (5с) Выполняет важные функции: - участвует в бактерицидном и и противоопухолевом эффектах лейкоцитов; - является связанным с эндотелием фактором, расслабляющим гладкие мышцы сосудов; - роль сигнальной молекулы в различных нейрональных функциях; - при повышенной продукции является медиатором воспаления при ревматических аутоимунных заболеваниях; - при повышенной продукции играет роль в росте опухолей; - участвует в расслаблении сосудов при действии ^ температур. - благодаря повышению активности гуанилатциклазы способствует трансмембранному переносу ионов Са2+. - тормозит агрегацию тромбоцитов.
Поиск по сайту: |
 Симптомы холеры и коклюша развиваются в результате действия токсинов, вырабатываемых соответствующими микроорганизмами.
Симптомы холеры и коклюша развиваются в результате действия токсинов, вырабатываемых соответствующими микроорганизмами.