 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Реакции на аминокислоты, содержащие тиоловую группу в восстановленном или окисленном состоянии (цистеин, цистин)
Биохимия Определение биологических молекул Задание: Даны растворы неизвестных биологических молекул. Необходимо определить молекулы, используя предложенные реактивы. Что делать: Для определения молекул необходимо провести максимально возможное (в зависимости от имеющихся реактивов) количество качественных реакций. В ответе требуется также перечислить результаты проведенных реакций и описать их механизмы.
Биуретовая реакция (белки). К исследуемому раствору необходимо добавить равный объем 10% раствора NaOH и несколько капель 5% CuSO4, после чего осторожно нагревать реакционную смесь в течение минуты. Если в растворе присутствует белок, то появится бледно-фиолетовое окрашивание. Механизм данной реакции связан с образованием комплексных соединений меди с атомами азота полипептидной цепи. Щелочная среда требуется для депротонирования атомов азота. Свое название реакция получила в связи с тем, что окрашивание в данных условиях помимо белков могут давать и некоторые другие соединения, содержащие CO-NH связи, например, биурет (H2N-CO-NH-CO-NH2), но не отдельные аминокислоты. Нингидриновая реакция (белки, аминокислоты). К исследуемому раствору необходимо добавить равный объем 1% раствора нингидрина, после чего осторожно нагревать реакционную смесь в течение минуты. Если в растворе присутствует белок, то появится сине-фиолетовое окрашивание. Окрашивание могут давать как белки, так и свободные аминокислоты. Образование окрашенного соединения (пурпура Руэманна) происходит в результате конденсации молекулы нингидрина, молекулы восстановленного нингидрина и молекулы аммиака. Механизм реакции приведен ниже.
Реакции на углеводы Йодная реакция (крахмал, гликоген). К исследуемому раствору необходимо добавить 1-2 капли раствора Люголя (I2 + KI в этиловом спирте). При наличие в растворе полисахарида крахмала появится бледно-синяя окраска, гликогена – красно-бурая окраска. Механизм данной реакции связан с образованием комплексных соединений полисахаридов и йода различной структуры. Комплекс йода с линейными полисахаридами (амилозой – одним из компонентов крахмала) имеет бледно-синюю окраску, при этом молекулы йода встраиваются между витками спирали амилозы. Комплекс йода с разветвленными полисахаридами (гликогеном) имеет красно-бурую окраску.
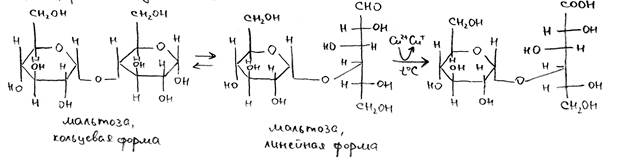
Реакции Троммера (моносахариды и восстанавливающие дисахариды). К исследуемому раствору необходимо добавить равный объем 10% раствора NaOH и несколько капель 5% CuSO4, после чего нагревать реакционную смесь в течение нескольких минут. Если в растворе присутствуют моносахариды или восстанавливающие дисахариды (мальтоза, лактоза), то будет наблюдаться появление оранжевого окрашивания. Механизм реакции связан с восстановлением двухвалентной меди до одновалентной альдегидной группой или кетогруппой, которое сопровождается образованием оранжевого Cu2O. В одинаковых условиях появление окраски происходит быстрее для кетоз (например, фруктозы), чем для альдоз (глюкозы, галактозы, мальтозы, лактозы и др.) Это связано с тем, что на одну их молекулу происходит восстановление двух атомов меди. В противном случае либо будет происходить выпадение черного осадка CuO, либо раствор будет сохранять фиолетовую окраску (в случае образования устойчивого комплекса меди с белками либо с невосстанавливающими дисахаридами – сахарозой).
Примечание: для проведения данной реакции вместо раствора CuSO4 может быть предложен реактив Фелинга, представляющий собой хелатный комплекс меди следующего вида:
Реакция Селиванова (фруктоза). К исследуемому раствору добавить равный объем концентрированной HCl и несколько капель раствора резорцина, после чего нагревать реакционную смесь в течение нескольких минут. Если в растворе присутствует фруктоза в свободной или в связанной форме (например, в составе сахарозы), будет наблюдаться ярко-красное окрашивание. Механизм реакции связан с дегидратацией фруктозы с образованием оксиметилфурфурола, который дает ярко-красную окраску при конденсации с резорцином.
Примечание: для проведения данной реакции может быть предложен реактив Селиванова, представляющий собой раствор резорцина в концентрированной HCl.
Реакция с орцином (пентозы). К исследуемому раствору добавить равный объем концентрированной HCl, несколько капель раствора орцина и несколько капель раствора, содержащего ионы Fe3+, после чего нагревать реакционную смесь в кипящей водяной бане в течение 15-20 мин. Если в растворе присутствуют пентозы в свободной или в связанной форме (например, в составе РНК). Механизм реакции связан с дегидратацией пентоз с образованием фурфурола, который дает зеленую окраску при конденсации с орцином.
Реакции на нуклеиновые кислоты Реакция с орцином (рибоза). См. выше.
Реакция с дифениламином (дезоксирибоза, рибоза).К исследуемому раствору добавить трехкратный объем 1% раствора дифениламина, после чего нагревать в кипящей водяной бане в течение 15-20 мин. Если в растворе присутствует дезоксирибоза, будет наблюдаться синее окрашивание, если в растворе присутствует рибоза – зеленое. Механизм реакции связан с гидролизом нуклеиновых кислот при длительном нагревании. Образующиеся при гидролизе пентозы образуют окрашенные комплексы с дифениламином.
Серебряная проба (пуриновые основания). К исследуемому раствору добавить равный объем 2% аммиачного раствора AgNO3, затем концентрированный аммиак до щелочной реакции (можно проверить по индикаторной бумажке). Если в растворе присутствуют пуриновые основания (аденин и гуанин) в составе нуклеиновых кислот, то через 5 мин выпадает рыхлый осадок серебряных соединений пуриновых оснований, окрашенный в светло-коричневый цвет.
Реакция Гольдмана. К исследуемому раствору добавить несколько капель раствора судана-III. Если в растворе присутствуют липиды, то через несколько минут будет наблюдаться появление оранжево-красного окрашивания. Механизм реакции связан с образованием комплекса судана-III с липидами, стабилизируемого гидрофобными взаимодействиями.
Реакции на аминокислоты 1. Общие реакции. При выполнении некоторых заданий иногда достаточно определить, есть ли в растворе аминокислоты, не различая разные виды этих соединений. Результат так называемых «общих» качественных реакций на аминокислоты говорит экспериментатору, присутствуют ли в растворе аминокислоты (любые) или таких соединений нет. К общим реакциям можно отнести нингидриновую и формальдегидную реакции, образование комплексов с металлами. Механизм нингидриновой реакции описан выше. Нингидриновая реакция достаточно широко используется в биохимической и медицинской практике для качественного и количественного определения содержания аминокислот в биологических жидкостях (кровь, моча, спинномозговая жидкость). 1.1. Реакция с формальдегидом. Реакция протекает за счет наличия аминогрупп в составе молекул аминокислот. К исследуемому нейтральному раствору приливают 1 каплю индикатора метилового красного. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавляют равный объем раствора формальдегида (формалина). Если в растворе есть аминокислоты, появляется красное окрашивание (реакция индикатора на кислую среду):
Примечание: Реакция не является высоко специфичной именно к аминокислотам – формальдегид может связываться и с аминогруппами иного происхождения – это следует иметь в виду при проведении экспериментов. 1.2. Образование комплексов с металлами.α-Аминокислоты, к которым относятся все протеиногенные аминокислоты, образуют с катионами тяжелых металлов внутрикомплексные соли (хелаты). Со свежеприготовленным гидроксидом меди(II) все α -аминокислоты в мягких условиях дают хорошо кристаллизующиеся хелатные соли меди(II) синего цвета:
Рассмотрим образование такого хелата в растворе аминокислоты на примере глицина. В пробирку наливают один объем раствора сульфата меди(II), добавляют несколько капель 10% раствора гидроксида натрия до образования голубого осадка. К полученному осадку гидроксида меди(II) приливают один объем раствора глицина. При этом образуется темно-синий раствор глицината меди:
2. Частные реакции. Частные качественные реакции позволяют обнаруживать в растворе аминокислоты из определенных групп (серусодержащие, циклические) или конкретные аминокислоты (цистеин, тирозин). Реакции определения наличия аминокислот в растворах основаны на различных химических особенностях, свойственных тем или иным аминокислотам или группам аминокислот. Все эти качественные реакции можно разделить на несколько групп в зависимости от химических свойств, на которые они опираются: · Реакции на индоловую группу (индольное кольцо) · Реакции на тиоловую (сульфгидрильную, -SH) группу · Реакции на фенолы · Реакции на гуанидиновую группу 2.1. Реакции на аминокислоты, содержащие ароматические радикалы Ксантопротеиновая реакция.Тирозин, триптофан, фенилаланин при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде эти нитропроизводные дают соли, окрашенные в оранжевый цвет. К исследуемому раствору прибавляют несколько капель концентрированной азотной кислоты и осторожно нагревают. При наличии в растворе ароматических аминокислот (или содержащих их белков) появляется желтое окрашивание.
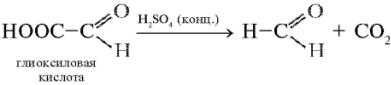
Реакция Адамкевича-Гопкинса-Коля (Шульца - Распайля) на триптофан (реакция на индоловую группу).Триптофан реагирует в кислой среде с альдегидами, образуя окрашенные продукты конденсации. Реакция протекает за счет взаимодействия индольного кольца триптофана с альдегидом. Известно, что из глиоксиловой кислоты в присутствии серной кислоты образуется формальдегид:
Растворы, содержащие триптофан, в присутствии глиоксиловой и серной кислот дают красно-фиолетовое окрашивание. Качественная реакция Адамкевича-Гопкинса-Коля может проводиться двумя основными способами. 1. Исследуемый раствор смешивают с равным объемом глиоксиловой кислоты и к смеси небольшими порциями прибавляют концентрированную серную кислоту (объем, приблизительно равный объему смеси), охлаждая пробирку после приливания очередной порции. Полученную смесь оставляют на 10 мин при комнатной температуре, после чего ставят на 5 мин в кипящую водяную баню. Наблюдается образование сине-фиолетового окрашивания. 2. Глиоксиловая кислота всегда присутствует в небольшом количестве в ледяной уксусной кислоте. Поэтому реакцию можно проводить, используя уксусную кислоту. При этом к исследуемому раствору добавляют равный объем ледяной (концентрированной) уксусной кислоты и осторожно нагревают до растворения осадка. После охлаждения к смеси осторожно по стенке (во избежание смешивания жидкостей) добавляют объем концентрированной серной кислоты, равный добавленному объему глиоксиловой кислоты. Через 5-10 минут на границе раздела двух слоев наблюдают образование красно-фиолетового кольца. Если перемешать слои, содержимое посуды равномерно окрасится в фиолетовый цвет. Конденсация триптофана с формальдегидом:
Продукт конденсации окисляется до бис-2-триптофанилкарбинола, который в присутствии минеральных кислот образует соли, окрашенные в сине-фиолетовый цвет:
Реакция Вуазена на триптофан (реакция на индоловую группу).Сходна с реакцией Адамкевича-Гопкинса-Коля, также основана на взаимодействии триптофана с альдегидами. В кислой среде в присутствии нитрита натрия и формальдегида индольное кольцо триптофана дает сине-фиолетовое окрашивание. В этой реакции триптофан взаимодействует с формальдегидом как показано на рисунке выше с образованием продукта конденсации (бис-2-триптофанилметана), который окисляется нитритом натрия до бис-2-триптофанилкарбинола. Последний в присутствии минеральных кислот образует соли сине-фиолетового цвета. К исследуемому раствору добавляют 1 каплю раствора формальдегида. К полученной смеси, тщательно перемешивая, добавляют осторожно по каплям двойной или тройной объем концентрированной серной кислоты, охлаждая пробирку. Через 10 минут добавляют, перемешивая, 10 капель раствора нитрита натрия. Наблюдают появление сине-фиолетовой окраски. Реакция Миллона на тирозин (реакция на фенольную группу).При нагревании раствора, содержащего фенолы, с реактивом Милона (смесь нитратов и нитритов ртути (I) и (П), растворенных в концентрированной азотной кислоте, реактив ядовит!) образуется осадок, окрашенный сначала в розовый, а затем в красный цвет. Реактив Милона дает окрашивание почти со всеми фенолами, в том числе с тирозином, радикал которого включает фенольное кольцо.
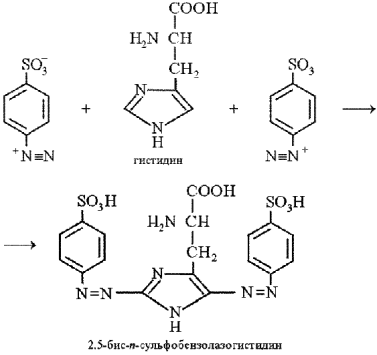
Реакция Паули на гистидин и тирозин.Реакция Паули позволяет обнаружить в белке аминокислоты гистидин и тирозин, которые образуют с диазобензолсульфоновой кислотой комплексные соединения вишнево-красного цвета. Диазобензолсульфоновая кислота образуется в реакции диазотирования при взаимодействии сульфаниловой кислоты с нитритом натрия в кислой среде:
К исследуемому раствору прибавляют равный объем кислого раствора сульфаниловой кислоты (приготовленного с использованием соляной кислоты) и двойной объем раствора нитрита натрия, тщательно перемешивают и сразу прибавляют соду (карбонат натрия). После перемешивания смесь окрашивается в вишнево-красный цвет при условии наличия гистидина или тирозина в исследуемом растворе.
Реакции на аминокислоты, содержащие тиоловую группу в восстановленном или окисленном состоянии (цистеин, цистин).
В связи с этим реакции определения тиолсодержащих аминокислот в растворе подразделяют на два этапа: · Переход серы из органического состояния в неорганическое · Обнаружение серы в растворе Для выявления сульфида натрия используют ацетат свинца, который при взаимодействии с гидроксидом натрия превращается в его плюмбит: Pb(CH3COO)2 + 2NaOH ® Pb(ONa)2 + 2CH3COOH В результате взаимодействия ионов серы и свинца образуется сульфид свинца черного или бурого цвета: Na2S + Pb(ONa)2 + 2H2O ® PbS¯ (черный осадок) + 4NaOH Для определения серусодержащих аминокислот к исследуемому раствору добавляют равный объем гидроксида натрия и несколько капель раствора ацетата свинца. При интенсивном кипячении в течение 3-5 минут жидкость окрашивается в черный цвет. Наличие цистина может быть определено с помощью этой реакции, так как цистин легко восстанавливается в цистеин.
Нитропруссидная реакция на цистеин.Сульфгидрильная (тиоловая) группа цистеина реагирует с нитропруссидом натрия в щелочной среде, образуя комплексное соединение,
Для определения цистеина к исследуемому раствору прибавляют равный объем раствора нитропруссида натрия, смесь подщелачивают и наблюдают появление красной окраски.
Поиск по сайту: |
 Реакции на белки и аминокислоты
Реакции на белки и аминокислоты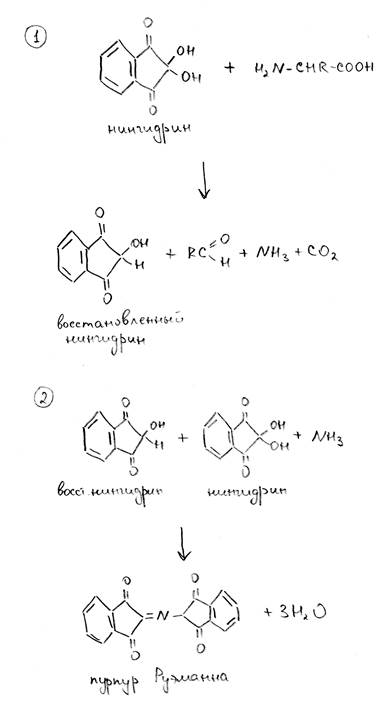





 Реакции на липиды
Реакции на липиды




 К исследуемому раствору добавляют несколько (3-5) капель реактива Милона и осторожно нагревают. При наличии в растворе тирозина (или других производных фенола) наблюдают выпадение окрашенного в красный цвет осадка в результате образования ртутной соли нитропроизводного тирозина. Образование красного раствора тоже является положительным результатом. В особых случаях (к примеру, при определении тирозина в составе некоторых белков) при проведении реакции Миллона образуется белый осадок, краснеющий при нагревании, что тоже считается положительным результатом теста.
К исследуемому раствору добавляют несколько (3-5) капель реактива Милона и осторожно нагревают. При наличии в растворе тирозина (или других производных фенола) наблюдают выпадение окрашенного в красный цвет осадка в результате образования ртутной соли нитропроизводного тирозина. Образование красного раствора тоже является положительным результатом. В особых случаях (к примеру, при определении тирозина в составе некоторых белков) при проведении реакции Миллона образуется белый осадок, краснеющий при нагревании, что тоже считается положительным результатом теста. 
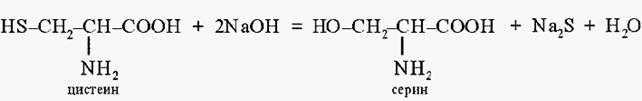 Реакция Фоля. При кипячении со щелочью от цистеина легко отщепляется сера в виде сероводорода, который в щелочной среде образует сульфид натрия:
Реакция Фоля. При кипячении со щелочью от цистеина легко отщепляется сера в виде сероводорода, который в щелочной среде образует сульфид натрия: окрашенное в красный цвет:
окрашенное в красный цвет: